
| V |
| Vm |
| m |
| M |
| 8.96L |
| 22.4L/mol |
| 4.8g |
| 16g/mol |
| 5.6g |
| 0.1mol |


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
| A、热稳定性:HF<HCl<HBr |
| B、微粒半径:O2->Mg2+>Cl- |
| C、第一电离能:Si>Al>Mg |
| D、电负性:Si>Al>Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:
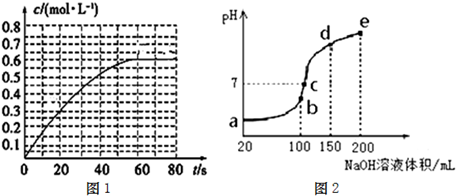
查看答案和解析>>
科目:高中化学 来源: 题型:
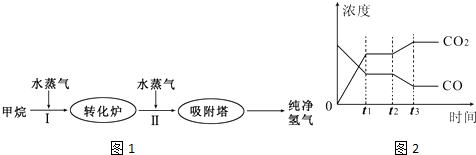
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正盐 | B、氧化物 |
| C、钾盐 | D、硫酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁跟稀硫酸反应:Fe+2H+=Fe2++H2↑ |
| B、Ca(HCO3)2溶液和盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑ |
| C、醋酸跟氢氧化钾溶液反应:CH3COOH+OH-=CH3COO-+H2O |
| D、Na2CO3跟稀硫酸反应:CO32-+2H+=H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com