
| A、铁跟稀硫酸反应:Fe+2H+=Fe2++H2↑ |
| B、Ca(HCO3)2溶液和盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑ |
| C、醋酸跟氢氧化钾溶液反应:CH3COOH+OH-=CH3COO-+H2O |
| D、Na2CO3跟稀硫酸反应:CO32-+2H+=H2O+CO2↑ |


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子式为C8H10的芳香烃,其一氯代物的种类不可能为1种 |
| B、天然橡胶的主要成分是异戊二烯,工业生产使之发生加聚反应才能使用 |
| C、蔗糖酯是一种食品乳化剂,可以由蔗糖与脂肪酸经酯化反应合成,蔗糖酯在稀硫酸的作用下充分水解只生成两种产物 |
| D、按照系统命名法,化合物(CH3)3CCH2C(CH3)=CH2的名称为2,4,4-甲基-2-戊烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 能收集O2、CO2,但不能收集H2 |
B、 可制备并收集少量NO2气体 |
C、 用于分离出溴苯 |
D、 用于将海带灼烧成灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | |
| D | E |
| A、A与B形成的微粒可能有:AB32-、AB2 |
| B、E的氢化物的沸点比C的氢化物的沸点高 |
| C、D在过量的B中燃烧的主要产物为DB2 |
| D、C、B、A的氢化物稳定性依次减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A、B、C的分子数比为1:3:2 |
| B、A、B、C的浓度相等 |
| C、C生成的速率与C分解的速率相等 |
| D、单位时间生成n mol A,同时生成3n mol B |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5mol?L-1 |
| B、1.0mol?L-1 |
| C、1.5mol?L-1 |
| D、2.0mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
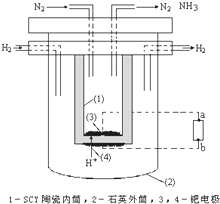 合成氨工业对国民经济和社会发展具有重要的意义.其原理为:
合成氨工业对国民经济和社会发展具有重要的意义.其原理为:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com