
| A、热稳定性:HF<HCl<HBr |
| B、微粒半径:O2->Mg2+>Cl- |
| C、第一电离能:Si>Al>Mg |
| D、电负性:Si>Al>Mg |


科目:高中化学 来源: 题型:
| A、1LH2SO4溶液中含98gH2SO4 |
| B、0.5 L含49gH2SO4的溶液 |
| C、98gH2SO4溶于水配成2 L溶液 |
| D、0.1 L含24.5gH2SO4的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(N2)=0.40mol?L-1?s-1 |
| B、v(H2)=0.80mol?L-1?s-1 |
| C、v(NH3)=0.60mol?L-1?s-1 |
| D、v(NH3)=1.20mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、ClO2在反应中是氧化产物 |
| B、NaClO3在反应中失去电子 |
| C、H2SO4在反应中作氧化剂 |
| D、1mol氧化剂在反应中得到1mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
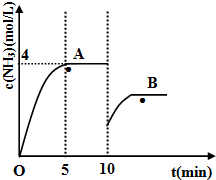 运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.| 压强/MPa转化率/%温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
| 7 |
| 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com