
| 微粒 | 电子数 | 质子数 | 中子数 | 质量数 | 原子结构示意图 |
| 1737Cl | |||||
| 818O |
 ;
; .
.| 微粒 | 电子数 | 质子数 | 中子数 | 质量数 | 原子结构示意图 |
| 1737Cl | 17 | 17 | 20 | 37 |  |
| 818O | 8 | 8 | 10 | 18 |  . . |


科目:高中化学 来源: 题型:
| A、向溴的煤油溶液里加入苯后振荡 |
| B、向溴水里加入酒精后振荡 |
| C、向硫的二硫化碳溶液里加水后振荡 |
| D、向碘水里加入四氯化碳后振荡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、热稳定性:HF<HCl<HBr |
| B、微粒半径:O2->Mg2+>Cl- |
| C、第一电离能:Si>Al>Mg |
| D、电负性:Si>Al>Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
| CO | H2O | H2 | CO | ||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 |

查看答案和解析>>
科目:高中化学 来源: 题型:
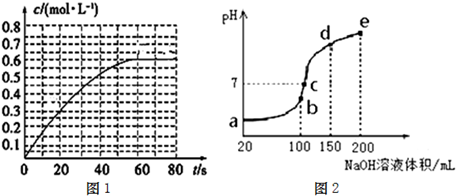
查看答案和解析>>
科目:高中化学 来源: 题型:
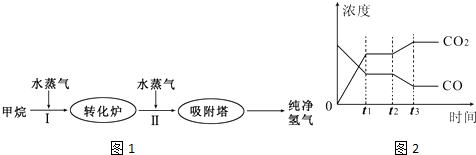
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正盐 | B、氧化物 |
| C、钾盐 | D、硫酸盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com