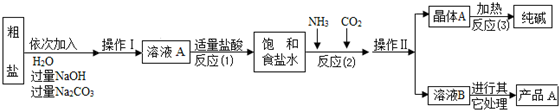
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
氨气是一种重要的化工原料,自1913年工业合成氨投产以来,合成氨工业不断发展,氨又可以进一步制备硝酸,在工业上可进行连续生产.请回答下列问题:
(1)在微电子工业中,氨水可作H
2O
2的清除剂,产物不污染环境.该反应的化学方程式为:
.
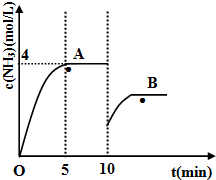
(2)在一定条件下,合成塔中氮气和氢气的起始浓度分别为amol?L
-1和bmol?L
-1,反应为:N
2+3H
2?2NH
3,氨气的浓度随时间变化如图所示.在10min时采取的措施是
,点A的平衡常数K
B点的平衡常数(填“<”、“>”或“=”).该反应的平衡常数表达式K=
.
(3)氨气溶于水得到氨水,在25℃下,将a mol?L
-1的氨水与b mol?L
-1的盐酸等体积混合,反应后溶液显中性,用含a和b的代数式表示出该混合溶液中氨水的电离平衡常数K=
.
Ⅱ工业上生产硫酸时,利用催化氧化反应将SO
2转化为SO
3是一个关键步骤.压强及温度对SO
2转化率的影响如表(原料气各成分的体积分数为:SO
27%,O
211%,N
282%):
| 压强/MPa转化率/%温度/℃ |
0.1 |
0.5 |
1 |
10 |
| 400 |
99.2 |
99.6 |
99.7 |
99.9 |
| 500 |
93.5 |
96.9 |
97.8 |
99.3 |
| 600 |
73.7 |
85.8 |
89.5 |
96.4 |
(4)已各SO
2的氧化是放热反应,如何利用表中数据推断此结论
.
(5)在大400~500℃时,SO
2的催化氧化采用常压而不是高压,主要原因是:
.
(6)某温度下,向1L密闭容器中开始充入2mol SO
2和1mol O
2,在V
2O
5催化剂存在时反应达到平衡,压强减小为开始时的
,求此温度下反应2SO
2(g)+O
2(g)?2SO
3(g)的达到平衡时SO
3的浓度
.(写出计算过程,结果保留3位有效数字)

 运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案