
| A、Ba(NO3)2和Na2SO3 |
| B、BaCO3和Na2SO4 |
| C、BaCl2和Na2SO4 |
| D、Ca(HCO3)2和Ca(OH)2 |


科目:高中化学 来源: 题型:
| A、分子式为C7H16的烷烃,含有3个甲基的同分异构体有2种 |
| B、丙烯能发生加成反应,还能使酸性KMnO4溶液褪色,但不能发生取代反应 |
| C、乙烷和丙烯的物质的量共1mol,完成燃烧生成3mol H2O |
| D、相同质量的甲烷和乙烷完全燃烧乙烷耗氧量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、啤酒开启后泛起大量泡沫 |
| B、实验室中常用排饱和食盐水的方法收集氯气 |
| C、将食物放在冰箱里延长保质期 |
| D、工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuSO4 (Cu(OH)2) |
| B、NaOH (NaOH) |
| C、NaCl (盐酸) |
| D、H2SO4(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1LH2SO4溶液中含98gH2SO4 |
| B、0.5 L含49gH2SO4的溶液 |
| C、98gH2SO4溶于水配成2 L溶液 |
| D、0.1 L含24.5gH2SO4的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-═Cl2↑+Mn2++H2O |
| B、将标准状况下1.12 L氯气通入10 mL1 mol/L的溴化亚铁溶液中:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 |
| C、向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
| D、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
| B、2mol | ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
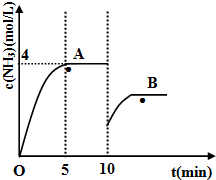 运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.| 压强/MPa转化率/%温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
| 7 |
| 10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com