
ΓΨΧβΡΩΓΩΕΧ÷ήΤΎ÷ςΉε‘ΣΥΊWΓΔXΓΔYΓΔZΒΡ‘≠Ή”–ρ ΐ“ά¥Έ‘ω¥σΘ§WΓΔXΓΔYΒΡΉνΆβ≤ψΒγΉ” ΐ÷°ΚΆ”κZΒΡΉνΆβ≤ψΒγΉ” ΐœύΒ»Θ§WΒΡΦρΒΞ«βΜ·Έο”κZΒΡΒΞ÷ ‘ΎΦ·ΤχΤΩ÷–ΜλΚœΚσΘ§Ζ≈÷Ο‘ΎΙβ‘¥œ¬ΖΔ…ζΖ¥”ΠΘ§ΤχΧε―’…Ϊ”…ΜΤ¬Χ…Ϊ≤ΜΕœ±δ«≥«“ΤΩ±Ύ…œ”–”ΆΉ¥Έο…ζ≥…ΓΘœ¬Ν–ΥΒΖ®¥μΈσΒΡ «Θ®ΓΓΓΓΘ©
A.≥Θ―Ιœ¬,≥ΘΦϊΒΞ÷ ΒΡΖ–ΒψΘΚ![]()
B.XάκΉ”ΒΡΒγΉ”≤ψΫαΙΙ”κYάκΉ”ΒΡœύΆ§
C.X”κZ–Έ≥…ΒΡΕΰ‘ΣΜ·ΚœΈοΒΡΥ°»ή“Κ≥ ÷––‘
D.ZΖ÷±π”κWΓΔY–Έ≥…ΒΡΕΰ‘ΣΜ·ΚœΈοΥυΚ§Μ·―ßΦϋάύ–ΆœύΆ§
ΓΨ¥πΑΗΓΩD
ΓΨΫβΈωΓΩ
ΕΧ÷ήΤΎ÷ςΉε‘ΣΥΊWΓΔXΓΔYΓΔZΒΡ‘≠Ή”–ρ ΐ“ά¥Έ‘ω¥σΘ§WΒΡΦρΒΞ«βΜ·Έο”κZΒΡΒΞ÷ ‘ΎΦ·ΤχΤΩ÷–ΜλΚœΚσΘ§Ζ≈÷Ο‘ΎΙβ‘¥œ¬ΖΔ…ζΖ¥”ΠΘ§ΤχΧε―’…Ϊ”…ΜΤ¬Χ…Ϊ≤ΜΕœ±δ«≥«“ΤΩ±Ύ…œ”–”ΆΉ¥Έο…ζ≥…Θ§ΗΟΖ¥”ΠΈΣΦΉΆι”ꬻΤχΒΡΖ¥”ΠΘ§‘ρWΈΣC‘ΣΥΊΘ§ZΈΣCl‘ΣΥΊΘΜWΓΔXΓΔYΒΡΉνΆβ≤ψΒγΉ” ΐ÷°ΚΆ”κZΒΡΉνΆβ≤ψΒγΉ” ΐœύΒ»Θ§XΓΔYΒΡΉνΆβ≤ψΒγΉ” ΐ÷°ΚΆΈΣ7-4=3Θ§Εΰ’Ώ‘≠Ή”–ρ ΐΕΦ¥σ”ΎCΘ§‘ρXΈΣNaΓΔYΈΣMg‘ΣΥΊΘ§Ψί¥ΥΫαΚœ‘ΣΥΊ÷ήΤΎ¬…÷Σ ΕΫβ¥πΓΘ
ΗυΨίΖ÷ΈωΩ…÷ΣΘ§WΈΣCΘ§XΈΣNaΘ§YΈΣMgΘ§ZΈΣCl‘ΣΥΊΓΘ
AΘ°≥ΘΈ¬≥Θ―Ιœ¬CΒΡΒΞ÷ ΈΣΙΧΧ§Θ§Εχ¬»ΤχΈΣΤχΧεΘ§‘ρΒΞ÷ ΒΡΖ–ΒψΘΚWΘΨZΘ§Ι A’ΐ»ΖΘΜ
BΘ°ΡΤάκΉ”ΚΆΟΨάκΉ”ΕΦΚ§”–2ΗωΒγΉ”≤ψΘ§Εΰ’ΏΒΡΒγΉ”≤ψΫαΙΙœύΆ§Θ§Ι B’ΐ»ΖΘΜ
CΘ°NaΓΔCl–Έ≥…ΒΡΜ·ΚœΈοΈΣNaClΘ§NaClΥ°»ή“Κ≥ ÷––‘Θ§Ι C’ΐ»ΖΘΜ
DΘ°Cl”κC–Έ≥…ΒΡΥΡ¬»Μ·ΧΦ÷ΜΚ§”–Ι≤ΦέΦϋΘ§ClΓΔMg–Έ≥…ΒΡ¬»Μ·ΟΨ÷ΜΚ§”–άκΉ”ΦϋΘ§Εΰ’ΏΚ§”–Μ·―ßΦϋ≤ΜΆ§Θ§Ι D¥μΈσΘΜ
¥πΑΗ―ΓDΓΘ



| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ»γΆΦΈΣ‘ΣΥΊ÷ήΤΎ±μΒΡ“Μ≤ΩΖ÷Θ§ΕΦΈΣΕΧ÷ήΤΎ‘ΣΥΊΘ§Z‘ΣΥΊΒΡΚΥΒγΚ… ΐΈΣQ‘ΣΥΊΒΡ2±ΕΓΘœ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «Θ® Θ©
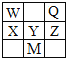
A.XΒΡΈΜ÷Ο «ΒΎ3÷ήΤΎΓΔΒΎΔτAΉε
B.ΗυΨί‘ΣΥΊ÷ήΤΎ¬…Θ§Ω…“‘ΆΤ≤βM‘ΣΥΊΒΡΒΞ÷ ΨΏ”–ΑκΒΦΧεΧΊ–‘
C.XΓΔYΓΔZΓΔQΒΡ‘≠Ή”ΑκΨΕ“ά¥ΈΦθ–ΓΘ§Ζ«Ϋπ τ–‘“ά¥ΈΫΒΒΆ
D.WΒΡΒΞ÷ ΚΆQΒΡ«βΜ·Έο‘Ύ“ΜΕ®ΧθΦΰœ¬Ω…ΖΔ…ζ÷ΟΜΜΖ¥”Π
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ‘Υ”ΟΜ·―ßΖ¥”Π‘≠άμΕ‘―–ΨΩ≤ΩΖ÷ΒΞ÷ ΦΑΤδΜ·ΚœΈοΒΡΖ¥”Π”–÷Ί“Σ“β“εΓΘ
Θ®1Θ©Α± «ΒΣ―≠ΜΖΙΐ≥Χ÷–ΒΡ÷Ί“ΣΈο÷ Θ§ «ΒΣΖ ΙΛ“ΒΒΡ÷Ί“Σ‘≠ΝœΓΘΑ±ΒΡΚœ≥… «ΡΩ«ΑΤ’±ι Ι”ΟΒΡ»ΥΙΛΙΧΒΣΖΫΖ®ΘΚN2(g)+3H2(g)![]() 2NH3(g)ΓΘ«κΜΊ¥πΘΚ
2NH3(g)ΓΘ«κΜΊ¥πΘΚ
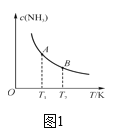
ΔΌ“―÷ΣHΓΣHΦϋΦϋΡήΈΣ436kJΓΛmol-1Θ§NΓ‘NΦϋΦϋΡήΈΣ945 kJΓΛmol-1Θ§NΓΣHΦϋΦϋΡήΈΣ391 kJΓΛmol-1ΓΘ”…ΦϋΡήΦΤΥψœϊΚΡ1 mol N2 ±ΒΡΠΛH=_____ΓΘ»τ‘ΎΚψΈ¬ΓΔΚψ―ΙΧθΦΰœ¬œρ…œ ωΤΫΚβΧεœΒ÷–Ά®»κΚΛΤχΘ§ΤΫΚβ____(ΧνΓΑœρΉσΓ±ΓΔΓΑœρ”“Γ±ΜρΓΑ≤ΜΓ±)“ΤΕ·ΓΘ
ΔΎ»γΆΦ÷–Θ§Β±Έ¬Ε»”…T1±δΜ·ΒΫT2 ±Θ§KA___(ΧνΓΑ>Γ±ΓΔΓΑ<Γ±ΜρΓΑ=Γ±)KBΓΘ
ΔέΖœΑ±Υ°Ω…“‘ΉΣΜ·≥…Α±Θ§Α±‘Ό…ηΦΤ≥…Φν–‘»ΦΝœΒγ≥ΊΓΘ»γΆΦ «ΗΟ»ΦΝœΒγ≥Ί Ψ“βΆΦΘ§≤ζ…ζΒΡXΤχΧεΩ…÷±Ϋ”≈≈Ζ≈ΒΫ¥σΤχ÷–ΓΘaΒγΦΪΉς____(ΧνΓΑ’ΐΓ±ΓΔΓΑΗΚΓ±ΓΔΓΑ“θΓ±ΜρΓΑ―τΓ±)ΦΪΘ§ΤδΒγΦΪΖ¥”Π ΫΈΣ____ΓΘ
Θ®2Θ©Ρ≥Έ¬Ε»œ¬‘Ύ»ίΜΐΙΧΕ®ΒΡΟή±’»ίΤς÷–Θ§œ¬Ν–Ζ¥”Π¥οΒΫΤΫΚβΘΚCO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
Τπ Φn(CO)ΓΟn(H2O) | COΉΣΜ·¬ | H2OΉΣΜ·¬ |
1ΓΟ1 | 0.5 | 0.5 |
1ΓΟ2 | 0.67 | 0.33 |
1ΓΟ3 | 0.75 | 0.25 |
ΔΌΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐΈΣ_____ΓΘΗΟΈ¬Ε»œ¬Θ§œρ»ίΤς÷–≥δ»κ1 mol COΓΔ3 mol H2OΓΔ2 mol CO2ΓΔ1.5 mol H2Θ§‘ρΤπ Φ ±ΗΟΖ¥”ΠΥΌ¬ v(’ΐ)______(ΧνΓΑ>Γ±ΓΔΓΑ<Γ±ΜρΓΑ=Γ±)v(Ρφ)ΓΘ
ΔΎΫαΚœ±μ÷– ΐΨίΘ§≈–Εœœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «_______(ΧνΉ÷ΡΗ)ΓΘ
AΘ°‘ωΦ”H2O(g)ΒΡΝΩΘ§COΒΡΉΣΜ·¬ …ΐΗΏΕχH2O(g)ΒΡΉΣΜ·¬ ΫΒΒΆ
BΘ°»τCO”κH2O(g)ΒΡΉΣΜ·¬ œύΆ§Θ§Εΰ’ΏΒΡ≥θ ΦΆΕ»κΝΩ“ΜΕ®œύΆ§
CΘ°COΚΆH2O(g)≥θ ΦΈο÷ ΒΡΝΩ÷°±»Β»”ΎΕΰ’ΏΉΣΜ·¬ ÷°±»
DΘ°Β±CO”κH2O(g)Έο÷ ΒΡΝΩ÷°±»ΈΣ1ΓΟ4 ±Θ§COΒΡΉΣΜ·¬ ΈΣ0.85
ΔέΗΟΈ¬Ε»œ¬Θ§œρ»ίΤς÷–≥δ»κ2 mol COΓΔ2 mol H2OΘ§¥οΤΫΚβ ±Ζ≈≥ωa kJ»»ΝΩΘ§‘ρΗΟΖ¥”ΠΒΡΠΛH=_____ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ≥μΜΖΖΦΧΰ»γίΝ![]() ΓΔΖΤ
ΓΔΖΤ ΓΔή≈
ΓΔή≈ Β»ΨυΈΣ÷Ί“ΣΒΡ”–ΜζΜ·ΙΛ‘≠ΝœΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
Β»ΨυΈΣ÷Ί“ΣΒΡ”–ΜζΜ·ΙΛ‘≠ΝœΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
A. ίΝΓΔΖΤΓΔή≈ΜΞΈΣΆ§œΒΈοB. ίΝΓΔΖΤΓΔή≈ΒΡ“Μ¬»¥ζΈοΖ÷±πΈΣ2ΓΔ5ΓΔ3÷÷
C. ίΝΓΔΖΤΓΔή≈÷–÷Μ”–ίΝΡή»ή”ΎΥ°D. ίΝΓΔΖΤΓΔή≈ΒΡΥυ”–‘≠Ή”≤ΜΩ…Ρή¥Π”ΎΆ§“ΜΤΫΟφ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬ΟφΝ–≥ωΝΥΦΗΉιΈο÷ Θ§«κΫΪΈο÷ ΒΡΚœ ΉιΚ≈Χν–¥‘ΎΩ’Ηώ…œΓΘ
ΔΌ ΫπΗ’ ·”κ ·ΡΪΘΜ ΔΎ““ΥαΚΆ¥ΉΥα
Δέ 16OΚΆ18OΘΜ ΔήCH3CH3ΚΆCH3CH2CH3ΘΜ
Δί![]() ΚΆ
ΚΆ
(1)Ά§÷÷Έο÷ ______________________________ΘΜ
(2)Ά§ΈΜΥΊ_________________________ΘΜ
(3)Ά§ΥΊ“λ–ΈΧε______________________________ΘΜ
(4)Ά§œΒΈο__________________________ΘΜ
(5)Ά§Ζ÷“λΙΙΧε______________________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–Ζ¥”Π τ”ΎΦ”≥…Ζ¥”ΠΒΡ «( )
A. 2CH3CH2OHΘΪO2![]() 2CH3CHOΘΪ2H2O
2CH3CHOΘΪ2H2O
B. CH2===CH2ΘΪHBr®DΓζCH3CH2Br
C. CH3CH2OHΘΪCH3COOH![]() CH3COOCH2CH3ΘΪH2O
CH3COOCH2CH3ΘΪH2O
D. CH4ΘΪCl2![]() CH3ClΘΪHCl
CH3ClΘΪHCl
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΝρΚΆΒΣΦΑΤδΜ·ΚœΈο‘Ύ…ζ≤ζ…ζΜν÷–”Π”ΟΙψΖΚΓΘ«κΜΊ¥πΘΚ
(1)“―÷ΣΖ¥”ΠΘΚ3NO2+H2O=2HNO3+NOΘ§ΗΟΖ¥”Π÷–ΒΡ―θΜ·ΦΝ”κΜΙ‘≠ΦΝΒΡ÷ ΝΩ±»ΈΣ_____ΓΘ
(2)ΙΛ“Β…œΩ…“‘Ά®ΙΐΒΣΤχΚΆ«βΤχ‘Ύ“ΜΕ®ΧθΦΰœ¬Κœ≥…Α±ΤχΓΘœ¬Ν–ΙΊ”ΎΑ±ΤχΒΡ–‘÷ ΚΆ”ΟΆΨΟη ω’ΐ»ΖΒΡ «____________ΓΘ
A. Α±Τχ“Ή“ΚΜ·Θ§“ΚΑ±Ω…Ής÷ΤάδΦΝ B. Ω…”Ο≈≈Υ°Ζ® ’Φ·Α±Τχ
C. Α±Τχ «“Μ÷÷Έό…ΪΈόΈΕΒΡΤχΧε D. œρΑ±Υ°÷–ΒΈΦ”Ζ”ΧΣΘ§»ή“Κ±δΚλ
(3)1754ΡξΘ§Briestly”Ο≥î…Α(÷ς“Σ≥…ΖίNH4Cl)ΚΆ λ ·Μ“Ι≤»»÷ΤΒΟΝΥΑ±Θ§Μ·―ßΖ¥”ΠΖΫ≥Χ ΫΈΣ______________________________ΓΘ
(4) Β―ι “”ΟΫπ τΆ≠ΚΆœΓœθΥα÷Τ»ΓNOΒΡάκΉ”ΖΫ≥Χ ΫΈΣ_____________ΓΘ
(5)Τϊ≥ΒΈ≤Τχ≥ΘΚ§”–NOΓΔNO2ΓΔCOΒ»Θ§ΜαΈέ»ΨΩ’ΤχΓΘ‘ΎΤϊ≥ΒΈ≤Τχ≈≈Ζ≈Ιή¥ΠΑ≤ΉΑ“ΜΗω¥ΏΜ·ΉΣΜ·ΤςΘ§Ω… ΙΈ≤Τχ÷–”–ΚΠΤχΧεCOΚΆNOΖ¥”ΠΉΣΜ·ΈΣΝΫ÷÷ΈόΕΨΤχΧεΘ§ΗΟΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ__________________________ΓΘ
(6)19.2 gΆ≠ΆΕ»κ100 mL 14 mol/L≈®HNO3»ή“Κ÷–Θ§≥δΖ÷Ζ¥”ΠΚσΈόΙΧΧε Θ”ύΘ§ ’Φ·ΒΫ±ξΉΦΉ¥Ωωœ¬ΤχΧε8.96 L(ΤχΧεΈΣNOΓΔNO2)Θ§œρΖ¥”ΠΚσΒΡ»ή“Κ÷–Φ”»κ______mL 10 mol/L NaOH»ή“Κ≤≈Ρή ΙCu2+Άξ»Ϊ≥ΝΒμΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
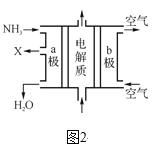
ΓΨΧβΡΩΓΩCuSO4 «“Μ÷÷÷Ί“ΣΜ·ΙΛ‘≠ΝœΘ§Τδ÷Τ±ΗΚΆ”–ΙΊ–‘÷ »γΆΦΥυ ΨΓΘ
Θ®1Θ©œ÷“Σ”Ο»γΆΦΥυ ΨΒΡ≈®ΝρΥαά¥≈δ÷Τ≤Ϋ÷ηΔΌ÷–Υυ–η“ΣΒΡ1mol/LΒΡœΓΝρΥα480mlΘ§–η“Σ”Ο’β÷÷≈®ΝρΥαΒΡΧεΜΐΈΣ______mlΓΘ
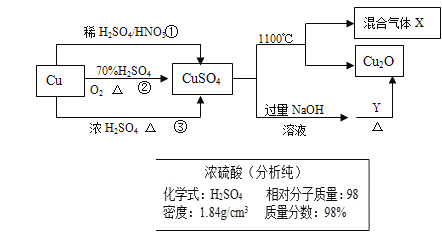
Θ®2Θ©≈δ÷ΤΗΟœΓΝρΥαΥυ”ΟΒΫΒΡ≤ΘΝß“«Τς≥ΐ≤ΘΝßΑτΓΔΝΩΆ≤ΓΔ…’±≠ΆβΜΙ”–_______ΓΔ__________ΓΘ
Θ®3Θ©œ¬Ν–≤ΌΉςΜα ΙΥυ≈δ»ή“Κ≈®Ε»ΤΪΒΆΒΡ « _________ΓΘ
A. ΝρΥαΉΣ“Τ÷Ν»ίΝΩΤΩΚσΘ§ΟΜ”–œ¥Β”…’±≠
B. Έ¥ά以÷Ν “Έ¬ΨΆΉΣ“Τ÷Ν»ίΝΩΤΩ
C. »ίΝΩΤΩ÷–¥φ‘Ύ…ΌΝΩ’τΝσΥ°
D. Ε®»ί ±Η© ”ΩΧΕ» E.ΝΩ»Γ≈®ΝρΥα ±ΝΩΆ≤ΡΎ”–…ΌΝΩ’τΝσΥ°
Θ®4Θ©÷Τ»ΓΝρΥαΆ≠ΒΡΆΨΨΕΔΌΔΎΔέ÷–Θ§ΆΨΨΕ_________ΡήΗϋΚΟΒΊΧεœ÷¬Χ…ΪΜ·―ßΒΡΥΦœκΓΘ
Θ®5Θ©≈δ÷Τ1000ml 0.1mol/LΒΡΝρΥαΆ≠»ή“ΚΘ§–η”ΟΆ–≈ΧΧλΤΫ≥Τ»Γ________gΒ®Ζ·ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΜ·―ßΖ¥”Π‘≠άμΕ‘Μ·―ßΖ¥”ΠΒΡ―–ΨΩΨΏ”–÷ΗΒΦ“β“εΓΘ
Θ®1Θ©ΜζΕ·≥ΒΖœΤχ≈≈Ζ≈“―≥…ΈΣ≥« –¥σΤχΈέ»ΨΒΡ÷Ί“Σά¥‘¥ΓΘΤχΗΉ÷–…ζ≥…NOΒΡΖ¥”ΠΈΣΘΚN2(g)+O2(g) ![]() 2NO(g) ΓςH ΘΨ0ΓΘΤϊ≥ΒΤτΕ·ΚσΘ§ΤχΗΉΡΎΈ¬Ε»‘ΫΗΏΘ§ΒΞΈΜ ±ΦδΡΎNO≈≈Ζ≈ΝΩ‘Ϋ¥σΘ§«κΖ÷ΈωΝΫΒψΩ…ΡήΒΡ‘≠“ρ___________ΓΔ_____________ΓΘ
2NO(g) ΓςH ΘΨ0ΓΘΤϊ≥ΒΤτΕ·ΚσΘ§ΤχΗΉΡΎΈ¬Ε»‘ΫΗΏΘ§ΒΞΈΜ ±ΦδΡΎNO≈≈Ζ≈ΝΩ‘Ϋ¥σΘ§«κΖ÷ΈωΝΫΒψΩ…ΡήΒΡ‘≠“ρ___________ΓΔ_____________ΓΘ
Θ®2Θ©”…ΫπΚλ ·TiO2÷Τ»ΓΒΞ÷ TiΘ§…φΦΑΒΫΒΡ≤Ϋ÷ηΈΣΘΚ
TiO2![]() TiCl4
TiCl4![]() Ti
Ti
“―÷ΣΘΚΔΌCsΘΪO2gΘΫCO2gΘΜ HΘΫ3935 kJΓΛmol1
ΔΎ2COgΘΪO2gΘΫ2CO2gΘΜ HΘΫ566 kJΓΛmol1
ΔέTiO2sΘΪ2Cl2gΘΫTiCl4sΘΪO2gΘΜ HΘΫ+141 kJΓΛmol1
‘ρTiO2sΘΪ2Cl2gΘΪ2CsΘΫTiCl4sΘΪ2COgΒΡHΘΫ________________ΓΘ
Θ®3Θ©¬»Τχ‘Ύ298KΓΔ100kPa ±Θ§‘Ύ1LΥ°÷–Ω…»ήΫβ0.09molΘ§ Β―ι≤βΒΟ»ή”ΎΥ°ΒΡCl2‘Φ”–1/3”κΥ°Ζ¥”ΠΓΘΗΟΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ______Θ§‘Ύ…œ ωΤΫΚβΧεœΒ÷–Φ”»κ…ΌΝΩNaOHΙΧΧεΘ§»ή“Κ÷–ClΓΣ≈®Ε»_______Θ®―ΓΧνΓΑ‘ω¥σΓ±ΓΔΓΑΦθ–ΓΓ±ΜρΓΑ≤Μ±δΓ±Θ©ΓΘ
Θ®4Θ©“ΜΕ®ΧθΦΰœ¬Θ§Fe3+ΚΆIΓΣ‘ΎΥ°»ή“Κ÷–ΒΡΖ¥”Π «2IΓΣ+2Fe3+![]() I2+2Fe2+Θ§Β±Ζ¥”Π¥οΒΫΤΫΚβΚσΘ§Φ”»κCCl4≥δΖ÷’ώΒ¥Θ§«“Έ¬Ε»≤Μ±δΘ§…œ ωΤΫΚβœρ_______Θ®―ΓΧνΓΑ’ΐΖ¥”ΠΓ±ΜρΓΑΡφΖ¥”ΠΓ±Θ©ΖΫœρ“ΤΕ·ΓΘ«κ…ηΦΤ“Μ÷÷ ΙΗΟΖ¥”ΠΒΡΜ·―ßΤΫΚβΡφœρ“ΤΕ·ΒΡ Β―ιΖΫΑΗ_____ΓΘ
I2+2Fe2+Θ§Β±Ζ¥”Π¥οΒΫΤΫΚβΚσΘ§Φ”»κCCl4≥δΖ÷’ώΒ¥Θ§«“Έ¬Ε»≤Μ±δΘ§…œ ωΤΫΚβœρ_______Θ®―ΓΧνΓΑ’ΐΖ¥”ΠΓ±ΜρΓΑΡφΖ¥”ΠΓ±Θ©ΖΫœρ“ΤΕ·ΓΘ«κ…ηΦΤ“Μ÷÷ ΙΗΟΖ¥”ΠΒΡΜ·―ßΤΫΚβΡφœρ“ΤΕ·ΒΡ Β―ιΖΫΑΗ_____ΓΘ
Θ®5Θ©”ΟCl2…ζ≤ζΡ≥–©Κ§¬»”–ΜζΈο ±Μα≤ζ…ζΗ±≤ζΈοHClΓΘάϊ”ΟΖ¥”ΠAΘ§Ω… Βœ÷¬»ΒΡ―≠ΜΖάϊ”ΟΓΘΖ¥”ΠAΘΚ4HClΘΪO2![]() 2Cl2ΘΪ2H2O
2Cl2ΘΪ2H2O
“―÷ΣΘΚΔΓΘ°¥ΥΧθΦΰœ¬Ζ¥”ΠA÷–Θ§4 mol HCl±Μ―θΜ·Θ§Ζ≈≥ω115.6 kJΒΡ»»ΝΩΓΘ
ΔΓΔΓ.![]()
![]()
ΔΌ–¥≥ω¥ΥΧθΦΰœ¬Θ§Ζ¥”ΠAΒΡ»»Μ·―ßΖΫ≥Χ Ϋ___________ΓΘ
ΔΎΕœΩΣ1 mol HΓΣOΦϋ”κΕœΩΣ1 mol HΓΣClΦϋΥυ–ηΡήΝΩœύ≤ν‘ΦΈΣ__________kJΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com