
【题目】CuSO4是一种重要化工原料,其制备和有关性质如图所示。
(1)现要用如图所示的浓硫酸来配制步骤①中所需要的1mol/L的稀硫酸480ml,需要用这种浓硫酸的体积为______ml。
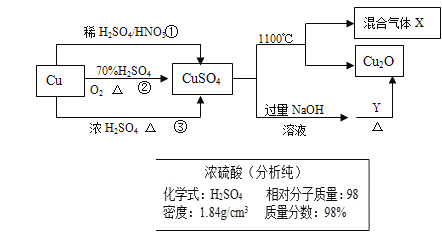
(2)配制该稀硫酸所用到的玻璃仪器除玻璃棒、量筒、烧杯外还有_______、__________。
(3)下列操作会使所配溶液浓度偏低的是 _________。
A. 硫酸转移至容量瓶后,没有洗涤烧杯
B. 未冷却至室温就转移至容量瓶
C. 容量瓶中存在少量蒸馏水
D. 定容时俯视刻度 E.量取浓硫酸时量筒内有少量蒸馏水
(4)制取硫酸铜的途径①②③中,途径_________能更好地体现绿色化学的思想。
(5)配制1000ml 0.1mol/L的硫酸铜溶液,需用托盘天平称取________g胆矾。
【答案】27.2 500ml容量瓶 胶头滴管 AE ② 25.0
【解析】
(1)配制1mol/L的稀硫酸480ml,需要用500ml容量瓶,因此配制稀硫酸的体积为500ml,根据图示,浓硫酸的浓度c(浓硫酸)=![]() ,设需要用这种浓硫酸的体积为Vml,根据稀释过程溶质的量不变,列关系式1mol/L×500ml=18.4mol/L×Vml,解得:V=27.2ml;
,设需要用这种浓硫酸的体积为Vml,根据稀释过程溶质的量不变,列关系式1mol/L×500ml=18.4mol/L×Vml,解得:V=27.2ml;
答案为:27.2
(2)配制该稀硫酸所用到的玻璃仪器玻璃棒、量筒、烧杯外、500ml容量瓶、胶头滴管;
答案为:500ml容量瓶、胶头滴管
(3)根据![]() 来进行分析,
来进行分析,
A. 未洗涤,所配溶液的溶质的质量减少,因此浓度减小,故A符合;
B. 未冷却至室温就转移至容量瓶,容量瓶内溶液冷却后,体积会减小,浓度偏高,故B不符合;
C. 容量瓶有无水,对实验无影响,故C不符合;
D. 定容时仰视读数,所配溶液的体积偏小,浓度增大,故D不符合;
E. 量筒含有少量的水,导致量取的溶质的体积减少,浓度减小,故E符合;
答案选AE
(4)途径①会产生有毒的一氧化氮气体,污染空气;途径②![]() ,硫酸利用率高,且不产生有污染的物质,故最好;途径③产生二氧化硫,二氧化硫有毒对环境有危害,且硫酸利用率低。
,硫酸利用率高,且不产生有污染的物质,故最好;途径③产生二氧化硫,二氧化硫有毒对环境有危害,且硫酸利用率低。
答案为:②;
(5)根据硫酸铜守恒,溶液中硫酸铜的物质的量等于胆矾中硫酸铜的物质的量,因此有![]() 。
。
答案为:25.0;


科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
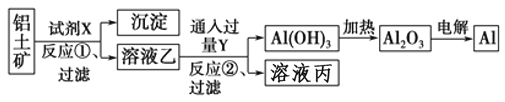
下列叙述正确的是
A. 按上述流程,试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氧化铁
C. 图中所有的转化反应都不是氧化还原反应
D. 反应②的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是重要的有机物,可由E和F在一定条件下合成:(部分反应物或产物省略,另请注意箭头的指向)
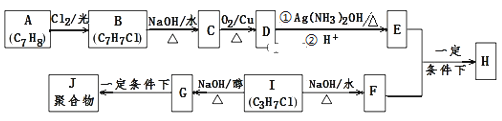
已知以下信息:
i.A属于芳香烃,H属于酯类化合物。
ii.I的核磁共振氢谱为二组峰,且峰的面积比为6:1。
回答下列问题:
(1)E的含氧官能团名称是 ______ ,B的结构简式是___________________。
(2)B→C和G→J两步的反应类型分别为 ___________,____________。
(3)①E+F→H的化学方程式是____________________________________。
②D与银氨溶液反应的化学方程式是__________________________________。
(4)E的同系物K比E相对分子质量大28,则K的同分异构体共 ______ 种,其中核磁共振氢谱显示为4组峰,且峰面积之比为6:2:1:1,写出符合要求的该同分异构体的结构简式为(写出1种即可) ____________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在120 ℃时,将a L乙烯、b L乙烷、c L乙炔(b>c)与d L氧气(过量)混合(a+b+c+d=25),点燃使之充分燃烧后,恢复至原来的温度,所得气体的体积可能是
A. 10 L B. 15 L C. 25 L D. 27 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知AgCl在水中的溶解是吸热过程。不同温度下,AgCl在水中的沉淀溶解平衡曲线如图所示。己知T1温度下Ksp(AgCl)=1.6×10-9,下列说法正确的是
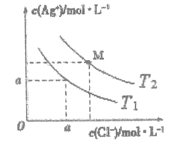
A. T1>T2
B. a =4.0×10-5
C. M点溶液温度变为T1时,溶液中Cl-的浓度不变
D. T2时饱和AgCl溶液中,c(Ag+)、c(Cl-)可能分别为2.0×10-5mol/L、4.0×10-5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是___。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是______________。
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
(3)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:
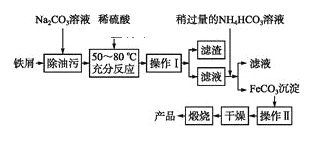
回答下列问题:
①操作Ⅰ的名称是____,操作Ⅱ的名称是____。②写出在空气中煅烧FeCO3的化学方程式________________。
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定。
a.称取2.850 g绿矾(FeSO4·7H2O)产品,溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测溶液放入锥形瓶中;
c.用硫酸酸化的0.01000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL。
①达到滴定终点时的现象____。
②某同学设计的下列滴定方式,最合理的是____。(夹持部分略去)(填字母序号)
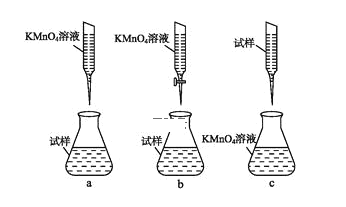
③计算上述样品中FeSO4·7H2O的质量分数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:
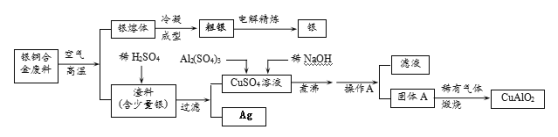
(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式:________________________。
(2)固体混合物A的组成为 、 。
(3)操作A的名称为_______________。
(4)若银铜合金中铜的质量分数为64%,理论上5.0 kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0 molL—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是 、 、过滤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
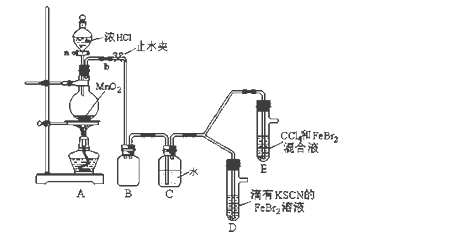
(1)①装置A中发生反应的离子方程式是_____________________。
②整套实验装置存在一处明显的不足,请指出_______________________。
(2)用改正后的装置进行实验,实验过程如下:
实验操作 | 实验现象 | 结论 |
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: ________________________ |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN-![]() Fe(SCN)3 是一个可逆反应。
Fe(SCN)3 是一个可逆反应。
ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2 。
ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
ⅳ.AgClO、AgBrO均可溶于水。
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________________________________________,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加______________溶液,若溶液颜色________,则上述解释是合理的。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释产生白色沉淀原因__________________、_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有两种活性反应中间体离子,它们的离子中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式:
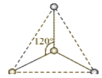 ___________;
___________;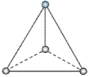 ______________。
______________。
(2)按要求写出第二周期非金属元素构成的中性分子的化学式。
平面三角形分子___________,三角锥形分子____________,正四面体形分子_____________。
(3)写出SO3的常见的等电子体的化学式:一价阴离子____________ (写出一种,下同),二价阴离子____________,它们的中心原子采用的杂化方式都是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com