
����Ŀ����������ͭ�Ƚ������仯�������ճ�������Ӧ�ù㷺�����������ʵ��ش�����:
(1)�����к���һ����̼������X(Fe3C)��X�������Ŀ����и������գ������д��ԵĹ���Y����Y���ڹ����������Һ�к��еĴ�����������___��
(2)ij��Һ����Mg2+��Fe2+��Al3+��Cu2+���������ӣ������м��������NaOH��Һ���ˣ��������������ղ������պ�Ĺ���Ͷ�������ϡ�����У�������Һ��ԭ��Һ��ȣ���Һ�д������ٵ���������______________��
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
(3)����������Ҫ��ҵ���ϣ��÷���м�Ʊ������������£�
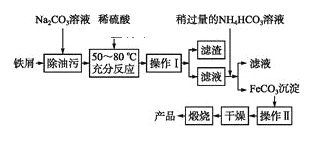
�ش���������:
�ٲ������������____���������������____����д���ڿ���������FeCO3�Ļ�ѧ����ʽ________________��
(4)��Щͬѧ��ΪKMnO4��Һ�ζ�Ҳ�ܽ�����Ԫ�غ����IJⶨ��
a.��ȡ2.850 g�̷�(FeSO4��7H2O)��Ʒ���ܽ⣬��250 mL����ƿ�ж��ݣ�
b.��ȡ25.00 mL������Һ������ƿ�У�
c.�������ữ��0.01000 mol��L-1KMnO4��Һ�ζ����յ㣬����KMnO4��Һ�����ƽ��ֵΪ20.00 mL��
�ٴﵽ�ζ��յ�ʱ������____��
��ijͬѧ��Ƶ����еζ���ʽ,���������____��(�гֲ�����ȥ)(����ĸ���)
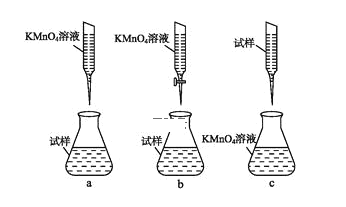
�ۼ���������Ʒ��FeSO4��7H2O����������Ϊ____��
���𰸡�Fe2+��Fe3+��H+ BC ���� ϴ�� 4FeCO3+ O2![]() 2Fe2O3+4CO2 ���������һ�θ��������Һ����Һ��dz��ɫ��ɷۺ�ɫ���Ұ��������ɫ���ٸı� b 97.5%
2Fe2O3+4CO2 ���������һ�θ��������Һ����Һ��dz��ɫ��ɷۺ�ɫ���Ұ��������ɫ���ٸı� b 97.5%
��������
(1)X�������Ŀ����и������գ������д��ԵĹ���Y��YΪ�����������������ᷴӦ�����Ȼ������Ȼ�������Y���ڹ����������Һ�д������ڵ���������Fe2+��Fe3+��H+
�ʴ�Ϊ��Fe2+��Fe3+��H+��
(2)���������NaOH��Һ��Mg2+��Fe2+��Cu2+ת��Ϊ�����������������Ʒ�Ӧ��������ƫ������������Һ�У����ս�����ת��Ϊ�����������պ�Ĺ���Ͷ�������ϡ���ᣬ��Һ�д���Mg2+��Fe3+��Cu2+����������Һ��ԭ��Һ��ȣ���Һ�д������ٵ���������Fe2+��Al3+���ʴ�Ϊ��BC��
(3)���Ʊ����̿�֪��̼����ˮ���Լ��ԣ��ɴٽ����۵�ˮ�⣬��ϡ�����ȥ̼���ƣ����ܽ�Fe������IΪ���ˣ���Һ�к�Fe2+����̼����立�Ӧ����̼����������������IIΪϴ�ӣ�Ȼ�������յõ���������
���ɹ������̿�֪������I�ǽ�������Һ����룬Ӧ��ȡ���˵ķ�����FeCO3�����ḽ���������ӣ���Ҫ����ϴ�ӣ��������ʣ�
�ʴ�Ϊ�����ˣ�ϴ�ӣ�
���ڿ���������FeCO3����������������Ϊ����������ѧ����ʽΪ��4FeCO3+ O2![]() 2Fe2O3+4CO2
2Fe2O3+4CO2
�ʴ�Ϊ��4FeCO3+ O2![]() 2Fe2O3+4CO2��
2Fe2O3+4CO2��
(4) ���������Ե����Ը�����أ��Ϻ�ɫ���ζ����л�ԭ�Ե�����������dz��ɫ��������������ԭ��Ӧ����������ת��Ϊ���������Ӵﵽ�ζ��յ�ʱ�������������һ�θ��������Һ����Һ��dz��ɫ��ɷۺ�ɫ���Ұ��������ɫ���ٸı䡣
��Ϊ�����������һ�θ��������Һ����Һ��dz��ɫ��ɷۺ�ɫ���Ұ��������ɫ���ٸı䡣
��������Һ��ǿ��������ҺӦ����ʽ�ζ��ܣ�
�ʴ�Ϊ��b
��n��MnO4-��=0.01000mol/L��0.02L=2��10-4mol������5Fe2++MnO4-+8H+�T5Fe3++Mn2++4H2O��֪n��Fe2+��=5��2��10-4mol=1��10-3mol��
����250mL��Һ�к���֪n��Fe2+��=1��10-2mol��
��m��FeSO47H2O��=278g/mol��1��10-2mol=2.780 g��
��Ʒ��FeSO47H2O����������Ϊ![]() ��100%=97.5%��
��100%=97.5%��
�ʴ�Ϊ��97.5%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������Ũ�Ⱦ�Ϊ![]() �����ᡢ���ᡢ����������Һ,�ش��������⣺
�����ᡢ���ᡢ����������Һ,�ش��������⣺
��1����������Һ��![]() �ֱ�Ϊ
�ֱ�Ϊ![]() ,�����ǵĴ�С��ϵΪ_________________________________________��
,�����ǵĴ�С��ϵΪ_________________________________________��
��2�������������������ֱ��������![]() ��Һ��Ӧ,�����ɵ��ε����ʵ�������Ϊ
��Һ��Ӧ,�����ɵ��ε����ʵ�������Ϊ![]() �������ǵĴ�С��ϵΪ__________________________��
�������ǵĴ�С��ϵΪ__________________________��
��3���ֱ��������������к�һ������![]() ��Һ��������,����Ҫ�������ֱ�Ϊ
��Һ��������,����Ҫ�������ֱ�Ϊ![]() �����С��ϵΪ__________________________________��
�����С��ϵΪ__________________________________��
��4���ֱ���п��Ӧ,��ʼʱ��������������Ϊ![]() �����С��ϵΪ______________________��
�����С��ϵΪ______________________��
��������![]() ����ǿ�����,������ˮ�е�������������ӣ�ÿ������ֻ��һ���������һ����ظ�����
����ǿ�����,������ˮ�е�������������ӣ�ÿ������ֻ��һ���������һ����ظ�����
������ |
|
������ |
|
��֪:��![]() ��Һ��
��Һ��![]() ������7,
������7, ![]() ����Һ��ˮ�ĵ���̶���ͬ����
����Һ��ˮ�ĵ���̶���ͬ����![]() ��Һ��
��Һ��![]() ��Һ����ʱֻ���ɰ�ɫ����,
��Һ����ʱֻ���ɰ�ɫ����, ![]() ��Һ��
��Һ��![]() ��Һ����ʱֻ���ɴ̼�����ζ������,
��Һ����ʱֻ���ɴ̼�����ζ������, ![]() ��Һ��
��Һ��![]() ��Һ���ʱ������
��Һ���ʱ������
��1�� ![]() ��_________________________��
��_________________________��![]() ��_______________________���ѧʽ����
��_______________________���ѧʽ����
��2���![]() ��
��![]() ��Ӧ�����ӷ���ʽ_________________________________��
��Ӧ�����ӷ���ʽ_________________________________��
��3�� ![]() ʱ,
ʱ, ![]() ��Һ��
��Һ��![]() ,��
,��![]() ��Һ��
��Һ��![]() _________________________________________���ú���
_________________________________________���ú���![]() �Ĺ�ϵʽ��ʾ����
�Ĺ�ϵʽ��ʾ����
��4����������������ʵ���Ũ�ȵ�![]() ��Һ��
��Һ��![]() ��Һ���,��Ӧ����Һ�и�������Ũ���ɴ�С��˳����_________________________��
��Һ���,��Ӧ����Һ�и�������Ũ���ɴ�С��˳����_________________________��
��5����һ�������![]() ��
��![]() ��Һ��,����һ�������
��Һ��,����һ�������![]() ������,�����Һ��
������,�����Һ��![]() ,����Ӧ����Һ���������
,����Ӧ����Һ���������![]() ��Һ����������֮��,��
��Һ����������֮��,��![]() ��Һ��������������_______________��
��Һ��������������_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ������N2��H2����ʵ�ֺϳɰ����������ֿ��Խ�һ���Ʊ����ᣬ�ڹ�ҵ��һ��ɽ���������������ش������й����⣺
��1����֪N2(g)+O2(g)=2NO(g) ��H =+180.5kJ��mol��1��N2(g)+3H2(g)![]() 2NH3(g) ��H =��92.4kJ��mol��1��2H2(g)+O2(g)=2H2O(g) ��H =��483.6kJ��mol��1��д����������������ȫ����һ��������ˮ�������Ȼ�ѧ����ʽΪ___________��
2NH3(g) ��H =��92.4kJ��mol��1��2H2(g)+O2(g)=2H2O(g) ��H =��483.6kJ��mol��1��д����������������ȫ����һ��������ˮ�������Ȼ�ѧ����ʽΪ___________��
��2����һ��������ܱ������У��������»�ѧ��Ӧ��N2(g)+3H2(g)![]() 2NH3(g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
2NH3(g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
t/K | 298 | 398 | 498 | ...... |
K/(mol/L)2 | 4.1��106 | K1 | K2 | ...... |
����������⣺
�ٱȽ�K1��K2�Ĵ�С��K1______K2(�>������=����<��)��
���ں��º�ѹ���жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������______(�����)��
A��2v(H2)(��)=3v(NH3)(��) B��2v(N2) (��)=v(H2) (��)
C��������ѹǿ���ֲ��� D�����������ܶȱ��ֲ���
��3�����Ṥҵ��β��NO�������Ʊ�NH4NO3���乤��ԭ����ͼ��
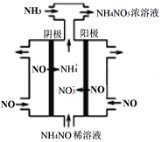
���������ĵ缫��ӦʽΪ___________��
�ڳ����£�1L pH=6��NH4NO3��Һ��c(NH3��H2O)+c(OH��)=________mol��L��1��
��4����ҵ���������صĻ�ѧ����ʽΪ��2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l)����T�棬���Ϊ4L���ܱ������У�ͨ��6mol NH3��3mol CO2����Ӧ�ﵽƽ��ʱ��c(NH3)=0.5mol��L��1��c(CO2)=0.25mol��L��1������ʱ����T���ƽ��ʱ������ѹǿ���䣬��������ɱ�������г���3mol NH3�����ʱ��Ӧ��v��____ v��(�>����<����=��)���ٴ�ƽ���ƽ�ⳣ��Ϊ______��
CO(NH2)2(s)+H2O(l)����T�棬���Ϊ4L���ܱ������У�ͨ��6mol NH3��3mol CO2����Ӧ�ﵽƽ��ʱ��c(NH3)=0.5mol��L��1��c(CO2)=0.25mol��L��1������ʱ����T���ƽ��ʱ������ѹǿ���䣬��������ɱ�������г���3mol NH3�����ʱ��Ӧ��v��____ v��(�>����<����=��)���ٴ�ƽ���ƽ�ⳣ��Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Z��WΪ����������Ԫ��,��Ԫ�����ڱ��е����λ������ͼ��ʾ,����ZԪ��ԭ��֮��ͨ���γ�Z2���ӡ�����˵������ȷ���ǣ� ��
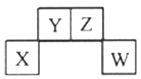
A. XԪ�صĵ��ʼ�����ǿ�ᷴӦҲ����ǿ�Ӧ
B. YԪ���γɵ��⻯���ڳ����²�һ��Ϊ����
C. WԪ�ص�����������Ӧˮ����һ��Ϊǿ��
D. ��Y��Z��W����Ԫ���γɵĶ�Ԫ��������ֻ�����ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CuSO4��һ����Ҫ����ԭ�ϣ����Ʊ����й�������ͼ��ʾ��
��1����Ҫ����ͼ��ʾ��Ũ���������Ʋ����������Ҫ��1mol/L��ϡ����480ml����Ҫ������Ũ��������Ϊ______ml��
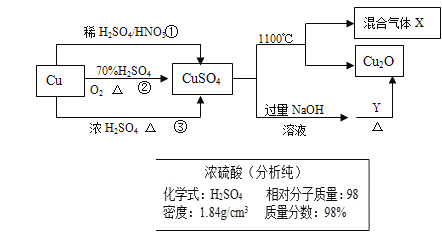
��2�����Ƹ�ϡ�������õ��IJ�������������������Ͳ���ձ����_______��__________��
��3�����в�����ʹ������ҺŨ��ƫ�͵��� _________��
A. ����ת��������ƿ��û��ϴ���ձ�
B. δ��ȴ�����¾�ת��������ƿ
C. ����ƿ�д�����������ˮ
D. ����ʱ���ӿ̶� E.��ȡŨ����ʱ��Ͳ������������ˮ
��4����ȡ����ͭ��;���٢ڢ��У�;��_________�ܸ��õ�������ɫ��ѧ��˼�롣
��5������1000ml 0.1mol/L������ͭ��Һ������������ƽ��ȡ________g������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж�ˮ��Һ�д��ڵĵ���ƽ��NH3��H2O ![]() NH4+��OH��������ȷ���ǣ�������
NH4+��OH��������ȷ���ǣ�������
A. ��ˮ����Һ��n(OH��)����
B. ��������Ũ���ᣬ��Һ��c(OH��)����
C. ��������ŨNaOH��Һ������ƽ�������ƶ�
D. ��������NH4Cl���壬��Һ��c(NH4+)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���Ʊ��������ʵ��������̺�������(����)
A. ��������ұ������������![]() Al2O3
Al2O3![]() AlCl3
AlCl3![]() Al
Al
B. �Ӻ�ˮ����ȡþ����ˮ![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
C. ��NaCl��Ư�ۣ�����ʳ��ˮ![]() Cl2
Cl2![]() Ư��
Ư��
D. �ɻ����������������![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����(����)
A. �ü��ȷ��ɳ�ȥNa2CO3�е�NaHCO3
B. Na2CO3�����ȶ��Դ���NaHCO3
C. ����ʯ��ˮ����Na2CO3��NaHCO3��Һ
D. Na2CO3��NaHCO3��ˮ��Һ���Լ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��Q��E����Ԫ���У�Xԭ�Ӻ����M����ֻ�����ԳɶԵ��ӣ�Yԭ�ӵĺ���L���������K���������Z�ǵؿ��ں���(��������)��ߵ�Ԫ�أ�Q�ĺ˵������X��Z�ĺ˵����֮�ͣ�E��Ԫ�����ڱ��ĸ�Ԫ���е縺�������ش��������⣺
(1)XZ2�ķ���ʽΪ__________�����ӵ����幹��Ϊ__________��
(2)YZ2�ĵ���ʽΪ__________��������к���__________��![]() ����__________��������
����__________��������
(3)Q��Ԫ�ط�����__________������__________�������ĺ�������Ų�ʽΪ__________���۵����Ų�ͼΪ__________�����γɻ�����ʱ����ߵĻ��ϼ�Ϊ__________��
(4)E�ĵ�����ˮ��Ӧ�Ļ�ѧ����ʽΪ__________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com