
【题目】X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子的核外L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大,请回答下列问题:
(1)XZ2的分子式为__________,分子的立体构型为__________。
(2)YZ2的电子式为__________,其分子中含有__________条![]() 键,__________条π键。
键,__________条π键。
(3)Q的元素符号是__________,属于__________区,它的核外电子排布式为__________。价电子排布图为__________,在形成化合物时它最高的化合价为__________。
(4)E的单质与水反应的化学方程式为__________。
【答案】SO2 V型 ![]() 2 2 Cr d区 ls22s22p63s23p63d54s1
2 2 Cr d区 ls22s22p63s23p63d54s1 ![]() +6 2F2+2H2O=4HF+O2
+6 2F2+2H2O=4HF+O2
【解析】
X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,则X为S元素;Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,故Y为C元素;Z是地壳内含量最高的元素,则Z为O元素,Q的核电荷数是X与Z的核电荷数之和,Q原子序数=16+8=24,故Q为Cr元素;E在元素周期表的各元素中电负性最大,则E为F元素。据此分析解答。
根据上述分析,X为S元素,Y为C元素,Z为O元素,Q为Cr元素,E为F元素。
(1)XZ2的分子式为SO2,其中S原子的价层电子对数=2+![]() =3,采用sp2杂化,分子的立体构型为V型,故答案为:SO2;V型;
=3,采用sp2杂化,分子的立体构型为V型,故答案为:SO2;V型;
(2)CO2为直线形分子,电子式为![]() ,其中含有2条
,其中含有2条![]() 键2条π键,故答案为:
键2条π键,故答案为:![]() ;2;2;
;2;2;
(3)Q为Cr元素,原子序数为24,核外电子排布式为1s22s22p63s23p63d54s1,属于d区元素;价电子排布图为![]() ,最高化合价为+6价,故答案为:Cr;d区;ls22s22p63s23p63d54s1;
,最高化合价为+6价,故答案为:Cr;d区;ls22s22p63s23p63d54s1;![]() ;+6;
;+6;
(4)氟气与水反应的化学方程式为2F2+2H2O=4HF+O2,故答案为:2F2+2H2O=4HF+O2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是___。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是______________。
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
(3)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:
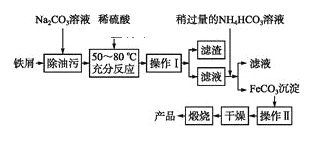
回答下列问题:
①操作Ⅰ的名称是____,操作Ⅱ的名称是____。②写出在空气中煅烧FeCO3的化学方程式________________。
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定。
a.称取2.850 g绿矾(FeSO4·7H2O)产品,溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测溶液放入锥形瓶中;
c.用硫酸酸化的0.01000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL。
①达到滴定终点时的现象____。
②某同学设计的下列滴定方式,最合理的是____。(夹持部分略去)(填字母序号)
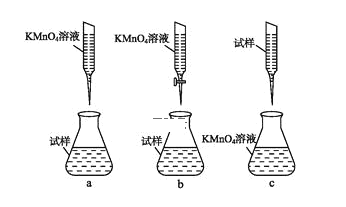
③计算上述样品中FeSO4·7H2O的质量分数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有五瓶损坏标签的试剂,分别盛有AgNO3溶液、稀硝酸、盐酸、氯化钡溶液、碳酸钾溶液,为了确定各瓶中是什么试剂,将它们任意编号为A、B、C、D、E,用小试管各盛少量多次进行两两混合反应,反应现象为:A与B、A与E均可产生白色沉淀,其中A与B反应所产生沉淀不溶于酸,A与E反应所生成的白色沉淀可以溶于C或D;B与D、B与E产生沉淀;E与C、E与D反应均可产生二氧化碳气体;而C与D由于属于同一类物质,混合时无反应现象。
由此,可判定各试剂瓶中所盛试剂为(用化学式表示)
A________;B________;C________;D________;E________。
另外,请写出下面要求的离子方程式:
(1)A与E:
________________________________________________________。
(2)A与B:
_________________________________________________________。
(3)C与E:
__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氯化铝的熔点为190℃(2.02×105Pa),但它在180℃即开始升华。
(1)氯化铝是________________(填“离子化合物”或“共价化合物”)。
(2)在500K和1.01×105Pa时,它的蒸气密度(换算成标准状况时)为11.92g·L-1,且已知它的结构中有配位键(当共价键中共用的电子对是由其中一原子独自供应,另一原子提供空轨道时,就形成配位键)。配位键形成后,就与一般共价键无异,氯化铝的化学式为________,结构式为________。
(3)无水氯化铝在空气中强烈地“发烟”,其原因是______________________。
(4)设计一个更可靠的实验,判别氯化铝是离子化合物还是共价化合物。你设计的实验是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有两种活性反应中间体离子,它们的离子中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式:
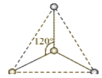 ___________;
___________;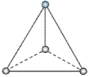 ______________。
______________。
(2)按要求写出第二周期非金属元素构成的中性分子的化学式。
平面三角形分子___________,三角锥形分子____________,正四面体形分子_____________。
(3)写出SO3的常见的等电子体的化学式:一价阴离子____________ (写出一种,下同),二价阴离子____________,它们的中心原子采用的杂化方式都是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙醇为原料,用下述6种类型的反应:①氧化,②消去,③加成,④酯化,⑤水解,⑥加聚,来合成乙二酸乙二酯(![]() )的正确顺序是( )
)的正确顺序是( )
A. ①⑤②③④B. ①②③④⑤
C. ②③⑤①⑥D. ②③⑤①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A.在标况下1mol N2的体积为22.4L/mol
B.分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
C.1L一氧化碳气体一定比1L氧气的质量小
D.常温常压下,8g O3中含有8NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需纯净的NaCl晶体,但现有的NaCl晶体中混有少量的Na2SO4和NH4HCO3,为除去杂质,甲同学设计了如下实验:(已知NH4HCO3 ![]() NH3↑+H2O+CO2↑)
NH3↑+H2O+CO2↑)
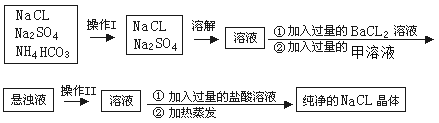
(1)上述操作I、II的名称分别为______、_______
(2)进行操作“加入过量的BaCl2溶液”时,如何判断BaCl2溶液已过量,其方法是______________________________________________________
(3)操作“加入过量的甲溶液”,甲溶液为______溶液,此操作的目的是________________________。
(4)操作“加入过量的盐酸溶液”的目的是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.0 mol/L盐酸逐滴滴入到100 mL含有NaOH、NaAlO2和Na2CO3的混合溶液中,反应过程如图所示。下列有关说法不正确的是
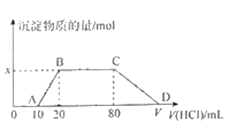
A. 混合液中NaOH的物质的量浓度为0.1 mol/L
B. x=0.01
C. BC段的反应过程离子方程式为:CO![]() +H+ ====HCO
+H+ ====HCO
D. V=110
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com