
【题目】25℃时,向20mL0.1mol/L的一元酸HA溶液中逐滴加入等物质的量浓度的KOH溶液,所得溶液的pH与加入KOH溶液体积的变化关系如图所示。下列说法不正确的是![]()
![]()
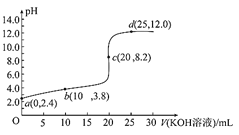
A.该温度下,A-的水解平衡常数的数量级为10-11
B.b点溶液中:c(H+)+c(HA)=c(A-)+c(OH-)
C.水的电离程度:c>b>d
D.当pH=7时,溶液中n(HA)与加入的n(KOH)之比为10-3.2
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】有某硫酸和硝酸的混合溶液20 mL,其中含硫酸的浓度为2 mol·L-1,含硝酸的浓度为1 mol·L-1,现向其中加入0.96 g铜粉,充分反应后(假设只生成NO气体),最多可收集到标准状况下的气体的体积为( )
A.224 mLB.168 mL
C.112 mLD.89.6 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】因在航空、核能、电池等高技术领域的重要作用——锂被称为“21世纪的能源金属”。三位科学家因在锂离子电池研发领域作出的贡献而获2019年诺贝尔化学奖。完成下列填空:
(1)锂位于元素周期表的___。已知金属熔点:锂>钠>钾,请根据晶体结构理论解释原因:___。
(2)氢化锂(LiH)是离子化合物,写出其阴离子的电子式__,LiH中阴离子半径大于阳离子半径,其原因是___。
(3)工业上用Li2CO3制取锂的化合物及金属锂。用Li2CO3、氨水和液溴制备LiBr·H2O的流程如下:
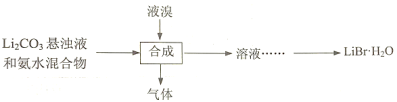
合成时,除生成LiBr外,还产生了两种参与大气循环的气体,补全产物并配平该反应的化学方程式:____Li2CO3+____Br2+____NH3·H2O→______LiBr+______+ ______。
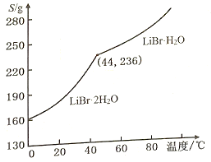
②溴化锂的溶解度随温度变化曲线如图所示,请补全从溶液中得到LiBr·H2O晶体的实验步骤:___、___、过滤、用乙醇洗涤,干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,1mol/L的HA和1mol/L的HB两种酸溶液,起始时的体积均为V0,分别向两溶液中加水进行稀释,所得变化关系如图所示(V表示溶液稀释后的体积)。下列说法错误的是

A. Ka( HA)约为10-4
B. 当两溶液均稀释至![]() 时,溶液中
时,溶液中![]() >
>![]()
C. 中和等体积pH相同的两种酸所用n(NaOH):HA>HB
D. 等体积、等物质的量浓度的NaA和NaB溶液中离子总数前者小于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读下面的信息,推断元素及有关物质,按要求回答物质:
信息①:X、Y、Z、W是常见的短周期元素,其原子序数依次增大,且原子核外最外层电子数均不少于2。
(1)根据信息①:X一定不是_________(填序号).
A.氢 | B.碳 | C.氧 | D.硫 |
信息②:上述四种元素的单质均能在足量的氧气中燃烧,生成的四种氧化物中,有两种能溶
于稀硫酸,三种能溶于浓氢氧化钠溶液,氧化物的相对分子质量都大于26。
(2)这四种元素中是否可能有一种是铝元素?_____________________________________。
信息③:向上述四种元素单质组成的混合物中加入足量盐酸溶液,固体部分溶解,过滤,向
滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀。
(3)白色沉淀物的化学式为____________________________________________________。
信息④:向上述四种元素单质组成的混合物中加入足量烧碱溶液,固体部分溶解,过滤,向
滤液中加入过量的盐酸溶液,最终溶液中析出白色沉淀。
(4)生成白色沉淀物的离子方程式为____________________________________________。
信息⑤:X与W同主族
(5)X与浓硫酸加热时反应的化学方程式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧元素有三种同位素,18O是氧的一种核素,下列说法正确的是
A. 18O原子所含质子数为18
B. 1mol 的1H218O分子所含中子数约为12NA个
C. 3.6g 的18O2气体的体积约为2.24 L
D. 18O2气体的摩尔质量为36 g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在含CH3COOH和CH3COO-的溶液中, CH3COOH、CH3COO-二者中各自所占的物质的量分数(a)随溶液pH变化的关系如图所示。

下列说法不正确的是
A. 在pH<4.76的溶液中,c(CH3COO-)<c(CH3COOH)
B. 在pH=7的溶液中,a(CH3COOH)=0,a(CH3COO-)=1.0
C. 在pH>4.76的溶液中,c(CH3COO-)与c(OH-)之和可大于c(H+)
D. 在pH=4.76的溶液中加盐酸,a(CH3COOH)与a(CH3COO-)之和保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是___(填编号),该错误操作会导致测定结果___(填“偏大”、“偏小”或“无影响”)。
(2)实验中用左手控制___,眼睛注视___,直至滴定终点。判断滴定终点的现象是:锥形瓶中溶液___。
(3)如图是某次滴定时的滴定管中的液面,其读数为___mL。
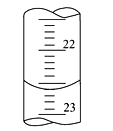
(4)根据下列数据:请计算待测盐酸溶液的浓度为___mol/L。
滴定次数 | 待测液体积(mL) | 标准液读数记录(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.42 | 20.40 |
第二次 | 20.00 | 2.28 | 22.30 |
第三次 | 20.00 | 0.20 | 22.60 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com