
【题目】现有一定温度下的密闭容器中存在如下反应:2SO2(g)+O2(g)2SO3(g),已知c(SO2)=0.4mol/L,c(O2)=1mol/L,经测定该反应在该温度下的平衡常数K=19,试判断:
(1)当SO2的转化率为50%时,该反应是否达到平衡状态,若未达到,向哪个方向进行?
(2)达平衡状态时,SO2的转化率应为多少?
【答案】
(1)解:利用三段式法解答,当SO2的转化率为50%时;
2SO2(g)+ | O2 (g) | 2SO3(g) | |||
起始: | 0.4mol/L | 1mol/L | 0 | ||
转化: | 0.2mol/L | 0.1mol/L | 0.2mol/L | ||
剩余: | 0.2mol/L | 0.9mol/L | 0.2mol/L |
Qc= ![]() =
= ![]() <19,
<19,
说明未达到平衡,向正方向进行.
答:未达到平衡,向正方向进行;
(2)解:利用三段式法解答,设氧气消耗量为x;
2SO2(g)+ | O2 (g) | 2SO3(g) | |||
起始(mol/): | 0.4 | 1 | 0 | ||
转化(mol/): | 2x | x | 2x | ||
平衡(mol/): | 0.4﹣2x | 1﹣x | 2x |
K= ![]() =19
=19
x≈0.16mol/L;
二氧化硫的转化率= ![]() ×100%=80%
×100%=80%
答:达平衡状态时,SO2的转化率为80%
【解析】(1)根据转化率计算此时各物质的浓度,计算各物质的浓度幂之积,与平衡常数相比较,如大于平衡常数,则平衡向逆向移动,反之向正向移动.


科目:高中化学 来源: 题型:
【题目】下列关于氯水的叙述,正确的是
A. 新制氯水中只含C12和H2O分子
B. 新制氯水可使蓝色石蕊试纸变红但不褪色
C. 光照氯水有气泡逸出,该气体是Cl2
D. 氯水放置数天后酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于组成细胞的微量元素的是( )
A. Zn Cu B MnB. Zn Cu K Ca
C. Fe Mn Zn MgD. S Mn Cu Mo
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度不变恒容的容器中0.1molL﹣1H2进行反应H22H,若某段时间内H2浓度由0.06molL﹣1降到0.036molL﹣1所需的反应时间为12s,则反应起始时H2浓度由0.1molL﹣1降到0.06molL﹣1需的时间为( )
A.等于24s
B.等于20s
C.大于20s
D.小于20s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要的物质,可用于制取化肥和硝酸等.已知H﹣H键、N﹣H键、N≡N键的键能分别是436kJ/mol、391kJ/mol、946kJ/mol.
(1)写出合成氨的热反应方程式 .
生成1molNH3需要吸收或放出kJ
(2)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示.图中t1 时引起平衡移动的条件可能是 . 其中表示平衡混合物中NH3的含量最高的一段时间是 . 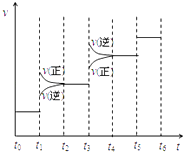
(3)温度为T℃时,将2a molH2和a molN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则该反应的平衡常数为 .
(4)已知373K时,可逆反应平衡常数为K=0.12,若某时刻时,测得 C(N2)=1mol/L,C(H2)=3mol/L,C(NH3)=2mol/L.此刻可逆反应
A.向正方向进行
B.向逆方向进行 C处于平衡状态.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定温度下的密闭容器中存在如下反应:2SO2(g)+O2(g)2SO3(g),已知c(SO2)=0.4mol/L,c(O2)=1mol/L,经测定该反应在该温度下的平衡常数K=19,试判断:
(1)当SO2的转化率为50%时,该反应是否达到平衡状态,若未达到,向哪个方向进行?
(2)达平衡状态时,SO2的转化率应为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 .
(2)烧杯间填满碎泡沫塑料的作用是 .
(3)理论上稀的强酸溶液与强碱溶液反应生成1mol水时放出57.3kJ的热量,写出表示稀盐酸和稀氢氧化钠溶液反应的中和热的热化学方程式:
(4)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大”、“偏小”或“无影响”).
(5)实验中改用60mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),所求中和热(填“相等”或“不相等”),简述理由: .
(6)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会(填“偏大”“偏小”或“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是____________。
(2)已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为____________。
(3)根据上述反应可推知___________。
a.氧化性:H3AsO4>KBrO3
b.氧化性:KBrO3>H3AsO4
c.还原性:X>AsH3
d.还原性:AsH3>X
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目___________
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,在溶液中因发生氧化还原反应而不能大量共存的是( )
A.K+、NH4+、NO3-、OH-
B.Na+、Ca2+、H+、HCO3-
C.K+、H+、NO3-、I-
D.K+、NO3-、Cl-、Mg2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com