
【题目】下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是
A. NH4Cl+NaOH=NaCl+NH3↑+H2O B. Mg3N2+6H2O=3Mg(OH)2+2NH3↑
C. Cl2+2NaOH=NaClO+NaCl+H2O D. 2Na2O2+2H2O=4NaOH+O2↑
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案科目:高中化学 来源: 题型:
【题目】脱硝通常指将烟气中的氮氧化物(NOx)转化为无害的物质。
(1)选择性催化还原技术(SCR)是目前最成熟的烟气脱硝技术,即在金属催化剂作用下,用还原剂(如NH3)选择性地与NOx反应生成N2和H2O。
①已知:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) △H=-905.5kJ mol-1
4NO(g)+6H2O(g) △H=-905.5kJ mol-1
N2(g)+O2(g)![]() 2NO(g) △H=+180kJ mol-1
2NO(g) △H=+180kJ mol-1
完成该方法中主要反应的热化学方程式:
4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) △H=____________。
4N2(g)+6H2O(g) △H=____________。
该方法应控制反应温度在315~400℃之间,反应温度不宜过低也不宜过高的原因是_________________。
②氨氮比[![]() ]会直接影响该方法的脱硝率,350℃时,只改变氨气的投放量,反应物X的转化率与氨氮比的关系如左下图所示,则X是______________(填化学式)。氨氮比由0.5增加到1.0时,脱硝主要反应的平衡将向_____________方向移动。当
]会直接影响该方法的脱硝率,350℃时,只改变氨气的投放量,反应物X的转化率与氨氮比的关系如左下图所示,则X是______________(填化学式)。氨氮比由0.5增加到1.0时,脱硝主要反应的平衡将向_____________方向移动。当![]() >1.0时,烟气中NO浓度反而增大,主要原因是__________________。
>1.0时,烟气中NO浓度反而增大,主要原因是__________________。

(2)直接电解吸收也是脱硝的一种方法,用6%的稀硝酸吸收NOx生成HNO2(—元弱酸),再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如右上图所示。
①图中b应连接电源的_____________(填“正极”或“负极”)。
②阳极的电极反应式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学方程式为____________________。利用反应6NO2+8NH3![]() 7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NH3在标准状况下是____L。
7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NH3在标准状况下是____L。
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH = -196.6 kJ·mol-1
2SO3(g) ΔH = -196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH = -113.0 kJ·mol-1
2NO2(g) ΔH = -113.0 kJ·mol-1
①则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH = ____ kJ·mol-1。
SO3(g)+NO(g)的ΔH = ____ kJ·mol-1。
②一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是____(填字母)。
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变 D.每消耗1 mol SO3的同时生成1 mol NO2
③测得上述反应平衡时NO2与SO2的体积比为1∶6,则平衡常数K=____。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。
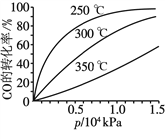
该反应的ΔH ____(填“>”或“<”)0。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是________________。
(4)煤燃烧产生的烟气也含氮的氧化物,用CH4催化还原NOx,可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g) ═ N2(g)+CO2(g)+2H2O(g) ΔH = -867 kJ·mol-1
2NO2(g)![]() N2O4(g) ΔH = -56.9 kJ·mol-1
N2O4(g) ΔH = -56.9 kJ·mol-1
H2O(g)![]() H2O(l) ΔH = -44 kJ·mol-1
H2O(l) ΔH = -44 kJ·mol-1
写出CH4 催化还原N2O4(g) 生成N2(g)、CO2(g) 和H2O(l)的热化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO =3H++6H2O+(CH2)6N4H+[滴定时,1 mol (CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500 g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤III 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤III 填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积_______(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察____________。
(A)滴定管内液面的变化 (B)锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由_________色变成_________色。
(2)滴定结果如下表所示:
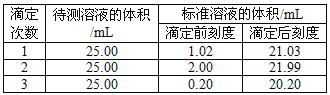
若NaOH标准溶液的浓度为0.1010 mol·L-1,则该样品中氮的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知H—H键键能(化学键断裂时吸收或形成时释放的能量)为436 kJ/mol,N—H键键能为391 kJ/mol,根据热化学方程式:N2(g)+3H2(g)===2NH3(g) ΔH=-92.4 kJ/mol,可知![]() 键的键能是______________kJ/mol
键的键能是______________kJ/mol
(2)碳(s)在氧气供应不充足时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应:C(s)+![]() O2(g)===CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________
O2(g)===CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________
(3)运动会中的火炬一般采用丙烷(C3H8)为燃料。丙烷热值较高,污染较小,是一种优良的燃料。试回答下列问题:
①如图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图,图中的括号内应填入___(“+”或“-”)。

②写出表示丙烷燃烧热的热化学方程式:________________。
(4)高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
由以上表格中数据判断以下说法不正确的是__________。
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中酸性最强的酸
C.在冰醋酸中硫酸的电离方程式为: H2SO4 = 2H++S![]()
D.水对这四种酸的强弱没有区分能力,但冰醋酸可以区分这四种酸的强弱
(5)常温下,0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数值变大的是________。
A.c(H+) B.![]() C.c(CH3COO-) D.c(CH3COOH)
C.c(CH3COO-) D.c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. Na与CuSO4溶液反应:2Na+Cu2+=2Na++Cu
B. 新制氯水中:Cl2+H2O ![]() 2H++ClO-+Cl-
2H++ClO-+Cl-
C. 200 mL 2 mol/L的FeBr2溶液中通入11.2L标准状况下的氯气:4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl-
D. 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3-+OH-= CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.石油的分馏、裂化、裂解属于化学变化B.煤的干馏、气化、液化属于物理变化
C.石油分馏后所得的汽油、煤油、柴油均是纯净物D.天然气、沼气的主要成分均是甲烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com