
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO =3H++6H2O+(CH2)6N4H+[滴定时,1 mol (CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500 g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤III 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤III 填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积_______(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察____________。
(A)滴定管内液面的变化 (B)锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由_________色变成_________色。
(2)滴定结果如下表所示:
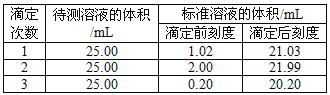
若NaOH标准溶液的浓度为0.1010 mol·L-1,则该样品中氮的质量分数为___________。
【答案】 偏高 无影响 B 无 粉红(或浅红) 18.85%
【解析】试题分析:(1)①碱式滴定管用蒸馏水洗涤后,没有用NaOH标准溶液润洗就直接加入NaOH标准溶液,使滴定的氢氧化钠溶液的浓度偏小,则消耗氢氧化钠标准溶液体积判断,得测得样品中(CH2)6N4H+偏多,因此结果氮的质量分数偏高;
②锥形瓶用蒸馏水洗涤后,水未倒尽,由于溶液中含有的被程度的物质的物质的量不变,则滴定时用去NaOH标准溶液的体积也不变,因此不会产生任何影响;
③滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶内溶液颜色的变化,故选项B正确;
④由于指示剂酚酞在酸溶液中,用已知浓度的碱滴定未知浓度的酸,因此开始溶液是无色,当滴定达到终点时,酚酞指示剂由无色变成浅红色;
(2)根据实验可知第一次实验反应消耗标准溶液的体积21.03mL-1.02mL=20.01mL;第二次实验反应消耗标准溶液的体积21.99mL-2.00mL=19.99ml;第三次实验反应消耗标准溶液的体积20.20mL-0.20mL=20.00ml;因此反应消耗标准溶液的体积是V=(20.01mL+19.99ml+20.00ml)÷3=20.00mL,根据酸、碱发生中和反应时的物质的量关系是1:1可知:c×25.00mL="0.1010" mol·L-1×20.00mL,解得c=0.0808mol/L,则250mL溶液中含有(CH2)6N4H+及H+的物质的量是0.0808mol/L×0.25L=0.0202mol,则在1.500 g样品中含NH4+的物质的量是0.0202mol,其中含有N的质量是m(N)=0.0202mol×14g/mol=0.2828g,所以N元素的质量分数是(0.2828g÷1.500 g)×100%=18.85%。


科目:高中化学 来源: 题型:
【题目】下列关于硝酸性质的说法不正确的是( )
A. 硝酸能与水易任意比互溶
B. 质量分数足够大时可形成发烟硝酸
C. 不易挥发,有刺激性气味
D. 浓硝酸因分解生成的二氧化氮又溶于硝酸而呈黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有下列6种离子中的某几种:Cl﹣、SO42﹣、NH4+、CO32﹣、K+、Na+ . 为确认溶液组成进行如下实验: ①200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶.
②向①的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出).
(1)溶液一定存在的离子有 , 可能存在的离子有;
(2)原溶液中c(CO32﹣)为 , c(NH4+)c(SO42﹣) (填“>、<或=”);
(3)如果上述6种离子都存在,则c(Cl﹣)c(SO42﹣) (填“>、<或=”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源、环境与生产生活和社会发展密切相关。
一定温度下,在两个容积均为2 L的密闭容器中,分别发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH = -49.0 kJ·mol-1。相关数据如下:
CH3OH(g)+H2O(g) ΔH = -49.0 kJ·mol-1。相关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 1 mol CO2(g)和3 mol H2(g) | 32g CH3OH(g)和18g H2O(g) |
平衡时c(CH3OH) | c1 | c2 |
平衡时能量变化 | 放出29.4 kJ | 吸收a kJ |
(1)c1____(填“>”、“<”或“=”)c2,a=____。
(2)该反应的平衡常数表达式为K=____;若甲中反应10 s 时达到平衡,则0~10 s内甲中的平均反应速率v(H2)=______。
(3)下列情况能说明该反应一定达到平衡状态的是____(填字母)。
a. v(CO2)消耗=v(CH3OH)生成 b. 气体的密度不再随时间改变
c. CO2和CH3OH的浓度之比不再随时间改变 d. 气体的平均相对分子质量不再随时间改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茶叶中铁元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( ) 
A.将茶叶灼烧灰化,选用①、②和⑨
B.用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦
C.过滤得到的滤液,选用④、⑤和⑦
D.检验滤液中的Fe3+ , 选用③、⑧和⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. NaCl溶于水与加热熔化时破坏的作用力不同
B. NH5的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构,是既具有离子键又具有共价键的离子化合物
C. 现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键
D. SiO2分子是由1个Si原子和两个O原子构成的原子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是
A. NH4Cl+NaOH=NaCl+NH3↑+H2O B. Mg3N2+6H2O=3Mg(OH)2+2NH3↑
C. Cl2+2NaOH=NaClO+NaCl+H2O D. 2Na2O2+2H2O=4NaOH+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关肥皂的叙述正确的有( )
①利用油脂在碱性条件下进行水解而制得
②普通肥皂的主要成分是高级脂肪酸钠和甘油
③使肥皂从油脂水解后的混合物中分离的过程是盐析
④肥皂制成后不能溶于水形成胶体
A.①②B.②④C.③④D.①③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com