
【题目】某溶液中可能含有下列6种离子中的某几种:Cl﹣、SO42﹣、NH4+、CO32﹣、K+、Na+ . 为确认溶液组成进行如下实验: ①200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶.
②向①的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出).
(1)溶液一定存在的离子有 , 可能存在的离子有;
(2)原溶液中c(CO32﹣)为 , c(NH4+)c(SO42﹣) (填“>、<或=”);
(3)如果上述6种离子都存在,则c(Cl﹣)c(SO42﹣) (填“>、<或=”).
【答案】
(1)CO32﹣、SO42﹣、NH4+;Cl﹣、K+、Na+
(2)0.05mol/L;大于
(3)>
【解析】解:①取少量该溶液加入BaCl2溶液有白色沉淀生成,再加入足量盐酸后,沉淀部分溶解,并有气体生成,说明白色沉淀为BaCO3和BaSO4 , 质量一共是4.3g,则溶液中含有CO32﹣、SO42﹣ , 向沉淀中加入过量的盐酸,有2.33g沉淀不溶,则硫酸钡的质量是2.33g,所以硫酸根离子的物质的量是 ![]() =0.01mol,所以碳酸钡的质量是4.3g﹣2.33g=1.97g,碳酸根离子的物质的量是
=0.01mol,所以碳酸钡的质量是4.3g﹣2.33g=1.97g,碳酸根离子的物质的量是 ![]() =0.01mol;②向①的滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体是氨气,物质的量是
=0.01mol;②向①的滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体是氨气,物质的量是 ![]() =0.05mol,说明溶液中有NH4+的物质的量是0.05mol;综合以上分析:(1)溶液一定存在的离子有:CO32﹣、SO42﹣、NH4+;可能存在的离子有:Cl﹣、K+、Na+ , 故答案为:CO32﹣、SO42﹣、NH4+;Cl﹣、K+、Na+;(2)依据计算得出c(CO32﹣)=
=0.05mol,说明溶液中有NH4+的物质的量是0.05mol;综合以上分析:(1)溶液一定存在的离子有:CO32﹣、SO42﹣、NH4+;可能存在的离子有:Cl﹣、K+、Na+ , 故答案为:CO32﹣、SO42﹣、NH4+;Cl﹣、K+、Na+;(2)依据计算得出c(CO32﹣)= ![]() =0.05mol/L,硫酸根为0.01mol,铵根为0.05mol,故c(NH4+)>(SO42﹣),故答案为:0.05mol/L;c(NH4+)>(SO42﹣);(3)依据溶液电中性原则,假设都存在,那么n(+)=n(﹣),即0.05+n(Na+)+n(K+)=2×0.01+2×0.01+n(Cl﹣),据此得出n(Cl﹣)=n(Na+)+n(K+)+0.01>0.01,故答案为:>. ①取少量该溶液加入BaCl2溶液有白色沉淀生成,再加入足量盐酸后,沉淀部分溶解,说明白色沉淀为BaCO3和BaSO4 , 则溶液中含有CO32﹣、SO42﹣;②向①的滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体,说明溶液中有NH4+ .
=0.05mol/L,硫酸根为0.01mol,铵根为0.05mol,故c(NH4+)>(SO42﹣),故答案为:0.05mol/L;c(NH4+)>(SO42﹣);(3)依据溶液电中性原则,假设都存在,那么n(+)=n(﹣),即0.05+n(Na+)+n(K+)=2×0.01+2×0.01+n(Cl﹣),据此得出n(Cl﹣)=n(Na+)+n(K+)+0.01>0.01,故答案为:>. ①取少量该溶液加入BaCl2溶液有白色沉淀生成,再加入足量盐酸后,沉淀部分溶解,说明白色沉淀为BaCO3和BaSO4 , 则溶液中含有CO32﹣、SO42﹣;②向①的滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体,说明溶液中有NH4+ .


 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】脱硝通常指将烟气中的氮氧化物(NOx)转化为无害的物质。
(1)选择性催化还原技术(SCR)是目前最成熟的烟气脱硝技术,即在金属催化剂作用下,用还原剂(如NH3)选择性地与NOx反应生成N2和H2O。
①已知:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) △H=-905.5kJ mol-1
4NO(g)+6H2O(g) △H=-905.5kJ mol-1
N2(g)+O2(g)![]() 2NO(g) △H=+180kJ mol-1
2NO(g) △H=+180kJ mol-1
完成该方法中主要反应的热化学方程式:
4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) △H=____________。
4N2(g)+6H2O(g) △H=____________。
该方法应控制反应温度在315~400℃之间,反应温度不宜过低也不宜过高的原因是_________________。
②氨氮比[![]() ]会直接影响该方法的脱硝率,350℃时,只改变氨气的投放量,反应物X的转化率与氨氮比的关系如左下图所示,则X是______________(填化学式)。氨氮比由0.5增加到1.0时,脱硝主要反应的平衡将向_____________方向移动。当
]会直接影响该方法的脱硝率,350℃时,只改变氨气的投放量,反应物X的转化率与氨氮比的关系如左下图所示,则X是______________(填化学式)。氨氮比由0.5增加到1.0时,脱硝主要反应的平衡将向_____________方向移动。当![]() >1.0时,烟气中NO浓度反而增大,主要原因是__________________。
>1.0时,烟气中NO浓度反而增大,主要原因是__________________。

(2)直接电解吸收也是脱硝的一种方法,用6%的稀硝酸吸收NOx生成HNO2(—元弱酸),再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如右上图所示。
①图中b应连接电源的_____________(填“正极”或“负极”)。
②阳极的电极反应式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.15g金属钠跟水反应后,得到100mL溶液,试计算:(已知方程式2Na+2H2O=2NaOH+H2↑)
(1)生成的气体在标准状况下是多少毫升?
(2)反应后所得溶液中溶质的物质的量浓度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氢氧化钠溶液和硫酸铜溶液加入某病人的尿液中,加热时如果发现有砖红色的沉淀产生,说明该尿液中可能含有下列物质中的( )
A.醋酸B.酒精C.食盐D.葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学方程式为____________________。利用反应6NO2+8NH3![]() 7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NH3在标准状况下是____L。
7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NH3在标准状况下是____L。
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH = -196.6 kJ·mol-1
2SO3(g) ΔH = -196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH = -113.0 kJ·mol-1
2NO2(g) ΔH = -113.0 kJ·mol-1
①则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH = ____ kJ·mol-1。
SO3(g)+NO(g)的ΔH = ____ kJ·mol-1。
②一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是____(填字母)。
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变 D.每消耗1 mol SO3的同时生成1 mol NO2
③测得上述反应平衡时NO2与SO2的体积比为1∶6,则平衡常数K=____。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。
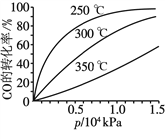
该反应的ΔH ____(填“>”或“<”)0。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是________________。
(4)煤燃烧产生的烟气也含氮的氧化物,用CH4催化还原NOx,可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g) ═ N2(g)+CO2(g)+2H2O(g) ΔH = -867 kJ·mol-1
2NO2(g)![]() N2O4(g) ΔH = -56.9 kJ·mol-1
N2O4(g) ΔH = -56.9 kJ·mol-1
H2O(g)![]() H2O(l) ΔH = -44 kJ·mol-1
H2O(l) ΔH = -44 kJ·mol-1
写出CH4 催化还原N2O4(g) 生成N2(g)、CO2(g) 和H2O(l)的热化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO =3H++6H2O+(CH2)6N4H+[滴定时,1 mol (CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500 g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤III 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤III 填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积_______(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察____________。
(A)滴定管内液面的变化 (B)锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由_________色变成_________色。
(2)滴定结果如下表所示:
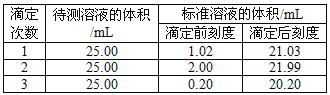
若NaOH标准溶液的浓度为0.1010 mol·L-1,则该样品中氮的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.石油的分馏、裂化、裂解属于化学变化B.煤的干馏、气化、液化属于物理变化
C.石油分馏后所得的汽油、煤油、柴油均是纯净物D.天然气、沼气的主要成分均是甲烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com