
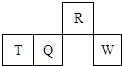
 短周期元素R、T、Q、W在元素周期标准的相对位置如图所示,其中T所处的周期序数和族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期标准的相对位置如图所示,其中T所处的周期序数和族序数相等.下列判断不正确的是( )| A、R的简单气态氢化物可以使湿润红色石蕊试纸变蓝 |
| B、W的最高价氧化物的水化物是一种强酸 |
| C、Q的最高价氧化物难溶于水 |
| D、T最高价氧化物的水化物是一种强碱 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
1 1 |
2 1 |
3 1 |
23 12 |
24 12 |
16 8 |
17 8 |
18 8 |
18 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 光 |
| Br2 |
| NaOH,醇 |
| △ |
| Br2水 |
| NaOH,H2O |
| O2,催化剂 |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、①③④ |
| C、①②④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=2的KHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
| B、含有AgCl和AgBr固体的悬浊液:c(Ag+)>c(Cl-)=c(Br-) |
| C、NaCl溶液和CH3COONH4溶液均呈中性,所以两溶液中水的电离程度相同 |
| D、PH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):②>③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com