
| A、①②③ | B、①③④ |
| C、①②④ | D、①②③④ |
| ||


科目:高中化学 来源: 题型:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点K | 1266 | 1534 | 183 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示的装置中,A、B均为石墨电极.回答下列问题:
如图所示的装置中,A、B均为石墨电极.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
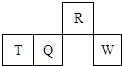 短周期元素R、T、Q、W在元素周期标准的相对位置如图所示,其中T所处的周期序数和族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期标准的相对位置如图所示,其中T所处的周期序数和族序数相等.下列判断不正确的是( )| A、R的简单气态氢化物可以使湿润红色石蕊试纸变蓝 |
| B、W的最高价氧化物的水化物是一种强酸 |
| C、Q的最高价氧化物难溶于水 |
| D、T最高价氧化物的水化物是一种强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向50 mL 1mol?L-1的盐酸中加入烧碱后,水的Kw不变 | ||
| B、NH4C1和NH3?H2O混合液中,二者对对方的平衡都起了抑制作用 | ||
| C、室温时某溶液的pH<7,则该物质一定是酸或强酸弱碱盐 | ||
D、常温下0.1 mol?L-1的HA溶液中
|
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaCl |
| B、NaCl、NaBr、NaI |
| C、NaCl、NaBr |
| D、NaCl、NaI |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com