
【题目】硼、铍及其化合物的应用正日益被重视。
⑴最重要的含铍矿物是绿柱石,含2%铬(Cr)的绿柱石即为祖母绿。基态Cr原子有______种运动状态的电子,基态Cr原子价电子的轨道表示式为______________。
⑵铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有___![]() 填标号
填标号![]() 。
。
A. 都属于p区主族元素 B. 电负性都比镁大
C. 第一电离能都比镁大 D.氯化物的水溶液pH均小于7
⑶铍、铝晶体都是由金属原子密置层在三维空间堆积而成(最密堆积)。铍的熔点(1551K)比铝的熔点(930K)高,原因是_______________________。
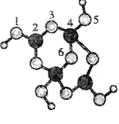
⑷硼砂是含结晶水的四硼酸钠,其阴离子的球棍模型如右图所示,其中硼原子的杂化方式为_________,配位键存在于_________原子之间。
⑸B4C可用于宝石等硬质材料的磨削、研磨等,其熔点为2350℃,沸点为3500℃,B4C属于____________晶体。
⑹层状硼酸铍的组成为H2BeB4O8。其中Be、B、O的电负性从大到小的顺序为___________;Be、B、O的第一电离能从大到小的顺序为___________。
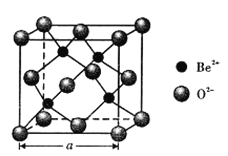
⑺BeO立方晶胞如图所示。若BeO晶体的密度为gcm-3,则晶胞参数a= ________nm(NA数值用6.02×1023表示)
 。
。
【答案】24 ![]() B、D Be原子半径比Al原子半径小,金属键更强 sp3和sp2 4、5 原子 O > B > Be O > Be > B
B、D Be原子半径比Al原子半径小,金属键更强 sp3和sp2 4、5 原子 O > B > Be O > Be > B ![]()
【解析】
⑴Cr是24号元素,基态Cr原子有24种运动状态的电子,基态Cr原子价电子的轨道表示式![]() 。
。
⑵ A. Be在s区;B. 同一周期,从左到右元素电负性递增,同一主族,自上而下元素电负性递减;C. Al的第一电离能小于Mg;D. Be和Al的氯化物都是强酸弱碱盐,水溶液呈酸性。
⑶Be原子半径比Al原子半径小,金属键更强,熔点更高。
⑷根据结构得出硼原子的杂化方式,4、5,配位键存在于4、5原子之间。
⑸根据B4C的磨削、研磨、熔点为2350℃,沸点为3500℃得出B4C晶体类型。
⑹非金属性越强,电负性越强,第一电离增大趋势但有特殊。
⑺根据密度等于质量除以体积。
⑴Cr是24号元素,基态Cr原子有24种运动状态的电子,基态Cr原子价电子的轨道表示式![]() ;故答案为:24 ;
;故答案为:24 ;![]() 。
。
⑵ A. Be在s区,故A项错误;
B. 同一周期,从左到右元素电负性递增,同一主族,自上而下元素电负性递减,故Be和Al的电负性都比![]() 大,故B项正确;
大,故B项正确;
C. Al的第一电离能小于Mg,故C项错误。
D. Be和Al的氯化物都是强酸弱碱盐,水溶液呈酸性,故D项正确;
综上所述,故答案为:BD。
⑶Be原子半径比Al原子半径小,金属键更强,熔点更高;故答案为:Be原子半径比Al原子半径小,金属键更强。
⑷硼原子的杂化方式为sp3和sp2,4、5,配位键存在于4、5原子之间;故答案为:sp3和sp2;4、5。
⑸B4C可用于宝石等硬质材料的磨削、研磨等,其熔点为2350℃,沸点为3500℃,据此可知B4C属于原子晶体;故答案为:原子。
⑹非金属性越强,电负性越强,故Be、B、O的电负性从大到小的顺序为O > B > Be;Be、B、O的第一电离能从大到小的顺序为O > Be > B,故答案为:O > B > Be;O > Be > B。
⑺M(BeO)=25gmol-1,因![]() ,所以
,所以 ;
;
故答案为:![]() 。
。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 实验室用Zn和稀硫酸制H2,为加快反应速率,可向稀硫酸中加入少量Cu粉
B. CH3Cl(g)+Cl2(g)![]() CH2Cl2(l)+HCl(g)常温下能自发进行,则该反应的ΔH>0
CH2Cl2(l)+HCl(g)常温下能自发进行,则该反应的ΔH>0
C. 在一体积可变的恒温密闭容器中发生反应PCl3(g)+Cl2(g) ![]() PCl5(g),压缩体积,平衡正向移动,K值增大
PCl5(g),压缩体积,平衡正向移动,K值增大
D. 25℃时Ka(HClO)=3.0×10-8,Ka(HCN)=4.9×10-10,若该温度下NaClO溶液与NaCN溶液pH相同,则c(NaClO)<c(NaCN)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,二氯化二硫(S2Cl2)为橙黄色液体,遇水易水解,工业上用于橡胶的硫化。某学习小组用氯气和硫单质合成S2Cl2的实验装置如图所示,下列说法不正确的是( )
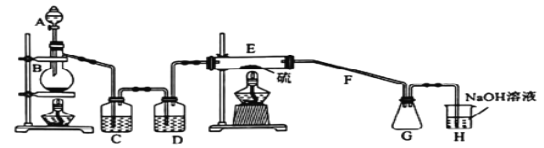
A. 实验时需后点燃E处的酒精灯
B. C、D中所盛试剂为饱和氯化钠溶液、浓硫酸
C. 二氯化二硫(S2Cl2)水解反应产物为S、H2S、HCl
D. G、H之间应加上D装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol·L-1NaHSO3(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是
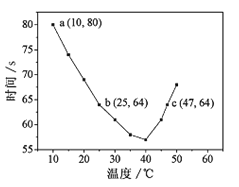
A. 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
B. 图中b、c两点对应的NaHSO3反应速率相等
C. 图中a点对应的NaHSO3反应速率为5.0 ×10-5mol·L-1·s-1
D. 温度高于40℃时,淀粉不宜用作该实验的指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某课外活动小组设计的用化学电源使LED灯发光的装置。下列说法不正确的是( )

A.装置中存在“化学能→电能→光能”的转化
B.锌片上发生的电极反应为![]()
C.如果将稀硫酸换成柠檬汁,则导线中不会有电子流动
D.如果将锌片换成铁片,则电路中的电流方向不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol过氧化钠与1.6mol碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是 ( )
A. Na2CO3 B. NaOH、Na2CO3 C. Na2O2、 Na2CO3 D. Na2O2、 NaOH 、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有可逆反应Fe(s)+CO2(g) ![]() FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
(1)能判断该反应达到平衡状态的依据是__________(双选,填序号)。
A.容器内压强不变了 B.c(CO)不变了
C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
(2)该反应的正反应是_________(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式__________。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=__________(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。
①升高温度__________;②再通入CO___________。
(5)该反应的逆反应速率随时间变化的关系如下图:

①从图中看到,反应在t2时达平衡, 在t1时改变了某种条件,改变的条件可能是(填序号)___________。(单选)
A.升温 B.增大CO2浓度
②如果在t3时从混合物中分离出部分CO,t4~ t5时间段反应处于新平衡状态,请在图上画出t3~ t5的V(逆)变化曲线______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
![]() +
+![]()
![]()
![]() +H2O
+H2O
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 水中溶解性 | |
异戊醇 | 88 | 0.8123 | 131 | 微溶 |
乙酸 | 60 | 1.0492 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |

实验步骤:
在A中加入4.4 g异戊醇、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50 min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
(1)仪器B的名称是______ ,其作用是_______。
(2)在洗涤操作中,第一次水洗的主要目的是________,第二次水洗的主要目的是__________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后_____(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是________。
(5)实验中加入少量无水MgSO4的目的是___________。
(6)本实验的产率是________。
(7)在进行蒸馏操作时,若从130℃开始收集馏分,会使实验的产率偏_____(填“高”或“低”),原因是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com