
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
![]() +
+![]()
![]()
![]() +H2O
+H2O
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 水中溶解性 | |
异戊醇 | 88 | 0.8123 | 131 | 微溶 |
乙酸 | 60 | 1.0492 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |

实验步骤:
在A中加入4.4 g异戊醇、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50 min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
(1)仪器B的名称是______ ,其作用是_______。
(2)在洗涤操作中,第一次水洗的主要目的是________,第二次水洗的主要目的是__________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后_____(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是________。
(5)实验中加入少量无水MgSO4的目的是___________。
(6)本实验的产率是________。
(7)在进行蒸馏操作时,若从130℃开始收集馏分,会使实验的产率偏_____(填“高”或“低”),原因是__________。
【答案】球形冷凝管 冷凝回流,提高反应物的利用率 洗掉大部分硫酸和醋酸 洗掉碳酸氢钠 d 提高醇的转化率 干燥 60% 高 会收集少量未反应的异戊醇
【解析】
实验室制备乙酸异戊酯的反应原理可知,生成的酯中含有杂质醇和酸,所以要进行净化处理,水洗、饱和碳酸氢钠溶液洗、再水洗;酯的密度小于水,不溶于水,可以采用分液法进行分离;该反应为可逆反应,增大乙酸的浓度,醇的转化率增大,有利于反应向右进行,提高产率;根据二者反应关系可知,乙酸过量,按照醇反应的量计算出产品酯的理论量,从而计算出产品的产率。
(1)由装置中仪器B的构造可以知道,仪器B的名称为球形冷凝管;作用是冷凝回流,避免反应物离开体系,提高反应物的利用率
(2)反应后的溶液要经过多次洗涤,在洗涤操作中,第一次洗涤的主要目的是除去大部分催化剂硫酸和醋酸; 第一次洗涤用饱和碳酸氢钠溶液既可以除去未洗净的醋酸,也可以降低酯的溶解度,但第一步洗涤后生成的酯中混有碳酸氢钠,所以第二次水洗,主要目的是除去产品中残留的碳酸氢钠;
(3)因为酯的密度比水小,二者互不相溶,因此水在下层,酯在上层;分液时,要先将水层从分液漏斗的下口放出,待到两层液体界面时关闭分液漏斗的活塞,再将乙酸异戊酯从上口放出,所以正确的为d;
(4)酯化反应是可逆反应,增大反应物的浓度可以使平衡正向移动;增加一种反应物的浓度可以使另一种反应物的转化率提高,因此本实验中加入过量乙酸的目的是提高转化率;
(5)实验中加入少量无水硫酸镁的目的是吸收酯中少量的水分,对乙酸异戊酯进行干燥;
(6)乙酸的物质的量为:![]() , 异戊醇的物质的量为:
, 异戊醇的物质的量为: ![]() ,因为乙酸和异戊醇是按照1: 1进行反应,所以乙酸过量生成乙酸异戊酯的量要按照异戊醇的物质的量计算,即理论上生成0.05mol乙酸异戊酯;实际上生成的乙酸异戊酯的物质的量为
,因为乙酸和异戊醇是按照1: 1进行反应,所以乙酸过量生成乙酸异戊酯的量要按照异戊醇的物质的量计算,即理论上生成0.05mol乙酸异戊酯;实际上生成的乙酸异戊酯的物质的量为![]() ,所以实验中乙酸异戊酯的产率为:
,所以实验中乙酸异戊酯的产率为:![]() = 60%;
= 60%;
(7)在进行蒸馏操作时若从130°C便开始收集馏分此时的蒸气中含有异戊醇,会收集少量的未反应的异戊醇,因此会导致产率偏高;


科目:高中化学 来源: 题型:
【题目】硼、铍及其化合物的应用正日益被重视。
⑴最重要的含铍矿物是绿柱石,含2%铬(Cr)的绿柱石即为祖母绿。基态Cr原子有______种运动状态的电子,基态Cr原子价电子的轨道表示式为______________。
⑵铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有___![]() 填标号
填标号![]() 。
。
A. 都属于p区主族元素 B. 电负性都比镁大
C. 第一电离能都比镁大 D.氯化物的水溶液pH均小于7
⑶铍、铝晶体都是由金属原子密置层在三维空间堆积而成(最密堆积)。铍的熔点(1551K)比铝的熔点(930K)高,原因是_______________________。
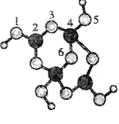
⑷硼砂是含结晶水的四硼酸钠,其阴离子的球棍模型如右图所示,其中硼原子的杂化方式为_________,配位键存在于_________原子之间。
⑸B4C可用于宝石等硬质材料的磨削、研磨等,其熔点为2350℃,沸点为3500℃,B4C属于____________晶体。
⑹层状硼酸铍的组成为H2BeB4O8。其中Be、B、O的电负性从大到小的顺序为___________;Be、B、O的第一电离能从大到小的顺序为___________。
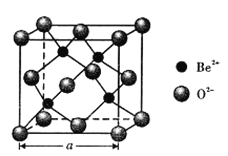
⑺BeO立方晶胞如图所示。若BeO晶体的密度为gcm-3,则晶胞参数a= ________nm(NA数值用6.02×1023表示)
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol·L-1NaOH溶液滴定新配制的25.0mL0.02 mol·L-1FeSO4溶液,应用手持技术测定溶液的pH与时间(t)的关系,结果如右图所示。下列说法错误的是
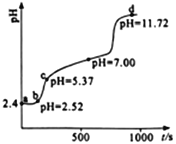
A. ab段,溶液中发生的主要反应:H++OH-=H2O
B. bc段,溶液中c(Fe2+) > (Fe3+) >c(H+)>c(OH-)
C. d点,溶液中的离子主要有Na+、SO42-、OH-
D. 滴定过程发生了复分解反应和氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时, H3A 水溶液(一种酸溶液)中含 A 的各种粒子的分布分数(平衡时某种粒子的浓度占各种粒子浓度之和的分数(α)与 pH 的关系如图所示。下列叙述正确的是( )
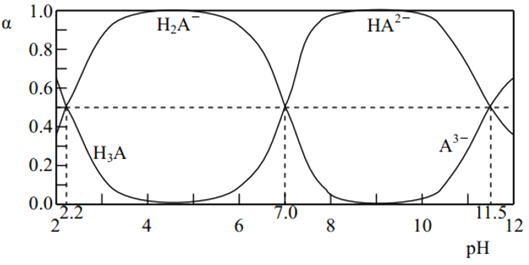
A. 根据图,可得 Ka1(H3A )≈10-7
B. 将等物质的量的 NaH2A 和 Na2HA 混合物溶于水,所得的溶液中 α(H2Aˉ)=α(HA2-)
C. 以酚酞为指示剂(变色范围 pH 8.2~10.0),将 NaOH 溶液逐滴加入到 H3A 溶液中,当溶液由无色变为浅红色时停止滴加,则生成 NaH2A
D. 在上述含 A 的各种粒子的体系中,若 c(H2Aˉ)+5c(A3ˉ)+c(OHˉ)=c(H+),则溶液pH为11.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在有机化学中应用广泛,例如有机合成中,常用铁和盐酸将硝基(-NO2)还原为氨基(-NH2);在苯的溴代反应中用溴化铁作催化剂。
(1)Fe基态原子核外电子排布式为________________________。
(2)H、N、O的电负性从小到大的顺序是_________________。
(3)与NO![]() 互为等电子体的一种分子为__________(填化学式)。氨基(-NH2)中氮原子的杂化类型为_____________。
互为等电子体的一种分子为__________(填化学式)。氨基(-NH2)中氮原子的杂化类型为_____________。
(4)1mol苯胺分子中含有σ键的数目为_____________________。
(5)Fe与N形成的某化合物晶胞如图所示,则该晶体的化学式为______________。
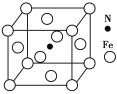
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的叙述正确的是( )
A.糖类、油脂、蛋白质都是有机高分子化合物
B.乙醇可以和金属钠反应很缓慢地放出氢气,说明乙醇的酸性很弱
C.有机物![]() 可以发生消去反应和催化氧化
可以发生消去反应和催化氧化
D.福尔马林可用作食品防腐剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() ,
,![]() 。
。![]() 时,向
时,向![]() 溶液中滴加氢氧化钠溶液,混合溶液的pOH与
溶液中滴加氢氧化钠溶液,混合溶液的pOH与![]() 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是

A.M点溶液中:![]()
B.![]() 的数量级为
的数量级为![]()
C.M点到N点: 的值不变
的值不变
D.N点:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲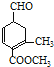 、乙
、乙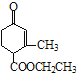 两种有机物,下列说法中不正确的是( )
两种有机物,下列说法中不正确的是( )
A.可用新制的氢氧化铜悬浊液区分这两种有机物
B.甲、乙互为同分异构体
C.甲在酸性和碱性条件下都能发生水解反应
D.等物质的量的甲、乙分别与足量NaOH溶液反应消耗NaOH的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式表示:盐碱地产生碱性的原因:______________;农业上用石膏降低其碱性的反应原理:__________。
(2)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m________(填“>”“<”或“=”)n。
(3)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中水电离出来的c(OH-)=__________。
(4)25 ℃时,将a mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,反应平衡时溶液中c(![]() )=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
)=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com