
【题目】有甲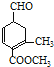 、乙
、乙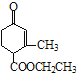 两种有机物,下列说法中不正确的是( )
两种有机物,下列说法中不正确的是( )
A.可用新制的氢氧化铜悬浊液区分这两种有机物
B.甲、乙互为同分异构体
C.甲在酸性和碱性条件下都能发生水解反应
D.等物质的量的甲、乙分别与足量NaOH溶液反应消耗NaOH的量相同
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】有可逆反应Fe(s)+CO2(g) ![]() FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
(1)能判断该反应达到平衡状态的依据是__________(双选,填序号)。
A.容器内压强不变了 B.c(CO)不变了
C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
(2)该反应的正反应是_________(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式__________。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=__________(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。
①升高温度__________;②再通入CO___________。
(5)该反应的逆反应速率随时间变化的关系如下图:

①从图中看到,反应在t2时达平衡, 在t1时改变了某种条件,改变的条件可能是(填序号)___________。(单选)
A.升温 B.增大CO2浓度
②如果在t3时从混合物中分离出部分CO,t4~ t5时间段反应处于新平衡状态,请在图上画出t3~ t5的V(逆)变化曲线______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
![]() +
+![]()
![]()
![]() +H2O
+H2O
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 水中溶解性 | |
异戊醇 | 88 | 0.8123 | 131 | 微溶 |
乙酸 | 60 | 1.0492 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |

实验步骤:
在A中加入4.4 g异戊醇、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50 min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
(1)仪器B的名称是______ ,其作用是_______。
(2)在洗涤操作中,第一次水洗的主要目的是________,第二次水洗的主要目的是__________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后_____(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是________。
(5)实验中加入少量无水MgSO4的目的是___________。
(6)本实验的产率是________。
(7)在进行蒸馏操作时,若从130℃开始收集馏分,会使实验的产率偏_____(填“高”或“低”),原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次从左至右发生的反应类型和反应条件都正确的是 ( )
选项 | 反应类型 | 反应条件 |
A | 加成反应;取代反应;消去反应 | KOH醇溶液 |
B | 消去反应;加成反应;取代反应 | NaOH水溶液 |
C | 氧化反应;取代反应;消去反应 | 加热;KOH醇溶液 |
D | 消去反应;加成反应;水解反应 | NaOH醇溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.10mol·L的氨水滴定l0.00mL0.05mol·L-1H2A溶液,加入氨水的体积(V)与溶液中lg![]() 的关系如图所示(忽略溶液体积变化)。下列说法不正确的是
的关系如图所示(忽略溶液体积变化)。下列说法不正确的是
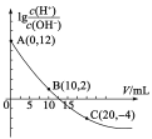
A.A点溶液的pH等于1
B.由图中数据可知,H2A为弱酸
C.B点水电离出的H+离子浓度为1.0×10-6mol·L-1
D.C点溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用如图所示装置进行有关实验:

(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整_________。
(2)实验中他们取6.4 g铜片和12 mL 18 mol·L1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①写出铜跟浓硫酸反应的化学方程式:__________________;
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是__________________;
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是________(填编号)。
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(3)装置C中试管D内盛装的是品红溶液,当B中气体收集满后,有可能观察到的现象是_____________,待反应结束后,向C中烧杯内加入沸水,D中观察到的现象是_____________。
(4)实验装置C有可能造成环境污染,试用最简单的方法加以解决,__________________(实验用品自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石油化工的一种产品A(乙烯)为主要原料合成一种具有果香味的物质E的生产流程如下:
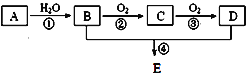
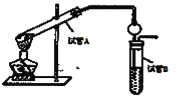
(1)步骤①的化学方程式_____________,反应类型____________。步骤②的化学方程式_____________________,反应类型____________。
(2)某同学欲用上图装置制备物质E,回答以下问题:
①试管A发生反应的化学方程式_____________。
②试管B中的试剂是__________。
(3)为了制备重要的有机原料——氯乙烷(CH3—CH2Cl),下面是两位同学设计的方案。
甲同学:选乙烷和适量氯气在光照条件下制备,原理是:CH3-CH3+Cl2![]() CH3CH2Cl+HCl。
CH3CH2Cl+HCl。
乙同学:选乙烯和适量氯化氢在一定条件下制备,原理是:CH2=CH2+HCl ![]() CH3CH2Cl。
CH3CH2Cl。
你认为上述两位同学的方案中,合理的是________(选填“甲同学”或“乙同学”),简述你的理由:____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G都是有机化合物,它们的转化关系如图所示:

请回答下列问题:
(1)已知:6.0g化合物E完全燃烧生成8.8gCO2和3.6gH2O;E的蒸气与氢气的相对密度为30,则E的分子式为___。
(2)A为一取代芳香烃,B中含有一个甲基。由B生成C的化学方程式为__。
(3)由C生成D的反应条件分别是__。
(4)由A生成B反应类型分别是__。
(5)F存在于栀子香油中,其结构简式为__。
(6)在G的同分异构体中,苯环上一硝化的产物只有一种的共有__种,其中核磁共振氢谱有两组峰,且峰面积比为1∶1的是__(填结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的短周期主族元素。X分别与Y、Z、W结合形成质子数相同的甲、乙、丙三种分子。丁为无色气体,遇空气变红棕色;丙的水溶液可刻蚀玻璃。
上述物质有如图转化关系:

下列说法错误的是
A. 四种元素形成的单质中W的氧化性最强
B. 甲、乙、丙中沸点最高的是丙
C. 甲常用作致冷剂
D. 甲、乙分子均只含极性共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com