
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次从左至右发生的反应类型和反应条件都正确的是 ( )
选项 | 反应类型 | 反应条件 |
A | 加成反应;取代反应;消去反应 | KOH醇溶液 |
B | 消去反应;加成反应;取代反应 | NaOH水溶液 |
C | 氧化反应;取代反应;消去反应 | 加热;KOH醇溶液 |
D | 消去反应;加成反应;水解反应 | NaOH醇溶液 |
A.AB.BC.CD.D
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.将0.10 mol·L-1氨水加水稀释后,溶液中c(![]() )·c(OH-)变大
)·c(OH-)变大
B.为确定某酸H2A是强酸还是弱酸,可测H2A溶液与H2SO4溶液的导电性。若导电性比硫酸弱,则H2A是弱酸。
C.将CH3COOH溶液加水稀释后,溶液中 变大
变大
D.用0.200 0 mol·L-1NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合溶液中两种酸的浓度均为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时, H3A 水溶液(一种酸溶液)中含 A 的各种粒子的分布分数(平衡时某种粒子的浓度占各种粒子浓度之和的分数(α)与 pH 的关系如图所示。下列叙述正确的是( )
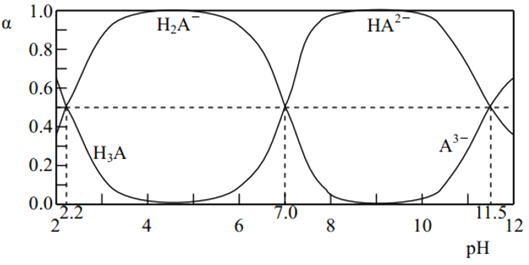
A. 根据图,可得 Ka1(H3A )≈10-7
B. 将等物质的量的 NaH2A 和 Na2HA 混合物溶于水,所得的溶液中 α(H2Aˉ)=α(HA2-)
C. 以酚酞为指示剂(变色范围 pH 8.2~10.0),将 NaOH 溶液逐滴加入到 H3A 溶液中,当溶液由无色变为浅红色时停止滴加,则生成 NaH2A
D. 在上述含 A 的各种粒子的体系中,若 c(H2Aˉ)+5c(A3ˉ)+c(OHˉ)=c(H+),则溶液pH为11.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的叙述正确的是( )
A.糖类、油脂、蛋白质都是有机高分子化合物
B.乙醇可以和金属钠反应很缓慢地放出氢气,说明乙醇的酸性很弱
C.有机物![]() 可以发生消去反应和催化氧化
可以发生消去反应和催化氧化
D.福尔马林可用作食品防腐剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() ,
,![]() 。
。![]() 时,向
时,向![]() 溶液中滴加氢氧化钠溶液,混合溶液的pOH与
溶液中滴加氢氧化钠溶液,混合溶液的pOH与![]() 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是

A.M点溶液中:![]()
B.![]() 的数量级为
的数量级为![]()
C.M点到N点: 的值不变
的值不变
D.N点:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mL浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释(溶液体积为V),溶液pH随lgV的变化情况如图所示,则下列说法正确的是( )
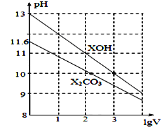
A. XOH是弱碱
B. pH=10的溶液中c(X+):XOH大于X2CO3
C. 已知CO32-的水解常数Kh1远远大于Kh2,则Kh1约为1.0×10-3.8
D. 当lgV=2时,升高X2CO3溶液温度,溶液碱性增强且c(HCO3-)/c(CO32-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲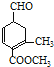 、乙
、乙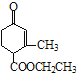 两种有机物,下列说法中不正确的是( )
两种有机物,下列说法中不正确的是( )
A.可用新制的氢氧化铜悬浊液区分这两种有机物
B.甲、乙互为同分异构体
C.甲在酸性和碱性条件下都能发生水解反应
D.等物质的量的甲、乙分别与足量NaOH溶液反应消耗NaOH的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓硝酸、浓硫酸反应生成SeO2以回收Se。在回收过程中涉及如下化学反应:①SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O;②Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O;③Se+4HNO3(浓)=SeO2+4NO2↑+2H2O;
下列有关叙述正确的是( )
A.氧化性由强到弱的顺序是H2SO4(浓)>SeO2>I2
B.反应①中Se是氧化产物,I2是还原产物
C.反应①中生成0.6molI2,转移的电子数目为2.4NA
D.反应②③中等量的Se消耗浓硫酸和浓硝酸中溶质的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学展开对漂白剂亚氯酸钠![]() 的研究.
的研究.
实验I:制取![]() 晶体
晶体
己知:![]() 饱和溶液在温度低于
饱和溶液在温度低于![]() 时析出晶体是
时析出晶体是![]() ,高于
,高于![]() 时析出晶体是
时析出晶体是![]() ,高于
,高于![]() 时
时![]() 分解成
分解成![]() 和
和![]() 。利用如图所示装置进行实验.
。利用如图所示装置进行实验.
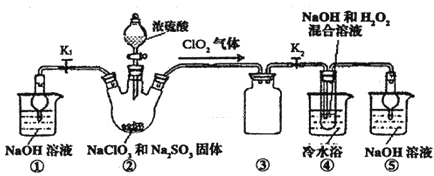
![]() 装置
装置![]() 的作用是 ______ ;装置
的作用是 ______ ;装置![]() 的作用是 ______ .
的作用是 ______ .
![]() 装置
装置![]() 中产生
中产生![]() 的还原剂是 ______ ;装置
的还原剂是 ______ ;装置![]() 中制备NaClO2的化学方程式为 ______ .
中制备NaClO2的化学方程式为 ______ .
![]() 从装置
从装置![]() 反应后的溶液获得
反应后的溶液获得![]() 晶体的操作步骤为:
晶体的操作步骤为:
![]() 减压,
减压,![]() 蒸发结晶;
蒸发结晶;
![]() 趁热过滤;
趁热过滤;
![]() ______ ;
______ ;
![]() 低于
低于![]() 干燥,得到成品.
干燥,得到成品.
实验Ⅱ:测定某亚氯酸钠样品的纯度.
设计如下实验方案,并进行实验:
![]() 准确称取所得亚氯酸钠样品mg于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应
准确称取所得亚氯酸钠样品mg于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应![]() 已知:
已知:![]() 将所得混合液配成250mL待测溶液.
将所得混合液配成250mL待测溶液.
![]() 移取
移取![]() 待测溶液于锥形瓶中,加几滴淀粉溶液,用c
待测溶液于锥形瓶中,加几滴淀粉溶液,用c ![]()
![]() 标准液滴定,至滴定终点。重复2次,测得平均值为V
标准液滴定,至滴定终点。重复2次,测得平均值为V ![]() 已知:
已知:![]()
![]() 达到滴定终点时的现象为 ______ .
达到滴定终点时的现象为 ______ .
![]() 该样品中
该样品中![]() 的质量分数为 ______
的质量分数为 ______ ![]() 用含m、c、V的代数式表示
用含m、c、V的代数式表示![]() .
.
![]() 在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为 ______ .
在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为 ______ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com