
【题目】1mL浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释(溶液体积为V),溶液pH随lgV的变化情况如图所示,则下列说法正确的是( )
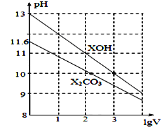
A. XOH是弱碱
B. pH=10的溶液中c(X+):XOH大于X2CO3
C. 已知CO32-的水解常数Kh1远远大于Kh2,则Kh1约为1.0×10-3.8
D. 当lgV=2时,升高X2CO3溶液温度,溶液碱性增强且c(HCO3-)/c(CO32-)减小
【答案】C
【解析】
A.0.1mol/L的XOH溶液的pH=13,说明XOH溶液中的OH-浓度等于XOH的浓度,XOH完全电离,为一元强碱,A项错误;
B.XOH是强碱溶液,X2CO3是强碱弱酸盐溶液,要使两种溶液pH相等则XOH浓度要小于X2CO3浓度,再结合物料守恒得出溶液中c(X+):XOH小于X2CO3,B项错误;
C.已知CO32-的水解常数Kh1远远大于Kh2,则不必考虑CO32-的第二步水解,不需要看第一步水解即可。从图中看出0.1mol/L的X2CO3的pH为11.6,则该溶液中c(OH-)=c(HCO3-)=10-2.4mol/L,c(CO32-)=0.1mol/L,则Kh1=(10-2.4)2/0.1=1.0×10-3.8,C项正确;
D.当lgV=2时,则溶液体积变为原来的100倍,升高温度促进水解,第一步水解程度远远大于第二步,所以溶液中c(CO32-)减小,c(HCO3-)增大,则比值变大,D项错误;


科目:高中化学 来源: 题型:
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制铵明矾晶体[NH4Al(SO4)2]的工艺流程如图所示:
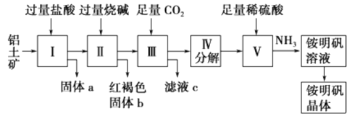
请回答下列问题:
(1)固体a的化学式为________,固体b化学式为________,Ⅲ中通入足量CO2气体发生反应的离子方程式为________________。
(2)由Ⅴ制取铵明矾溶液的化学方程式为__________________。
(3)由Ⅰ→Ⅱ→Ⅲ→Ⅳ都要用到的分离方法是__________________,由铵明矾溶液中制铵明矾晶体的操作是__________________。
(4)如果先向铝土矿加入过量氢氧化钠,再加入过量盐酸,此时首先出现的固体a是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知AgCl在水中的溶解是吸热过程。不同温度下,AgCl在水中的沉淀溶解平衡曲线如图所示。己知T1温度下Ksp(AgCl)=1.6×10-9,下列说法正确的是
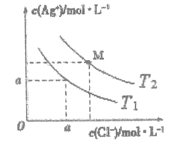
A. T1>T2
B. a =4.0×10-5
C. M点溶液温度变为T1时,溶液中Cl-的浓度不变
D. T2时饱和AgCl溶液中,c(Ag+)、c(Cl-)可能分别为2.0×10-5mol/L、4.0×10-5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:
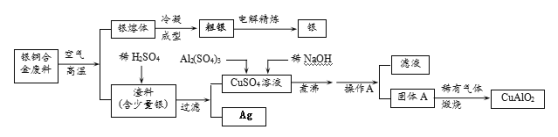
(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式:________________________。
(2)固体混合物A的组成为 、 。
(3)操作A的名称为_______________。
(4)若银铜合金中铜的质量分数为64%,理论上5.0 kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0 molL—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是 、 、过滤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )

A. 图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则等物质的量浓度的NaA和NaB混合溶液中:c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+)
B. 图2中在b点对应温度下,将pH=2的H2SO4溶液与pH=12的NaOH溶液等体积混合后,溶液显中性
C. 用0.0100 mol/L硝酸银标准溶液,滴定浓度均为0.1000 mol/L Cl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl-
D. 图4表示在N2(g)+3H2(g) ![]() 2NH3(g)达到平衡后,减小NH3浓度时速率的变化
2NH3(g)达到平衡后,减小NH3浓度时速率的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
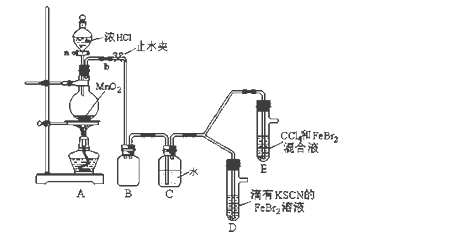
(1)①装置A中发生反应的离子方程式是_____________________。
②整套实验装置存在一处明显的不足,请指出_______________________。
(2)用改正后的装置进行实验,实验过程如下:
实验操作 | 实验现象 | 结论 |
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: ________________________ |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN-![]() Fe(SCN)3 是一个可逆反应。
Fe(SCN)3 是一个可逆反应。
ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2 。
ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
ⅳ.AgClO、AgBrO均可溶于水。
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________________________________________,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加______________溶液,若溶液颜色________,则上述解释是合理的。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释产生白色沉淀原因__________________、_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法会对人体健康造成较大危害的是( )
A. 用小苏打(NaHCO3)焙制糕点
B. 用大量SO2漂白馒头
C. 用食醋清洗热水瓶胆内壁附着的水垢(CaCO3)
D. 用消毒液(有效成分NaClO)对医用物品进行杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅(SiO2)又称硅石,是制备硅及其化合物的重要原料(各种转化见图)。下列说法正确的是
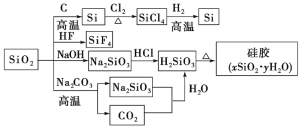
A. SiO2既能与HF反应,又能与NaOH反应,属于两性氧化物
B. SiO2和Si都是光导纤维材料
C. 硅胶吸水后可重复再生
D. 图中所示转化反应都是非氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃和101kPa时,甲烷、乙炔和乙烯组成的混合烃10mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小17.5mL,则原混合烃中乙炔的体积分数为
A.12.5% B.25% C.50% D.75%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com