
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制铵明矾晶体[NH4Al(SO4)2]的工艺流程如图所示:
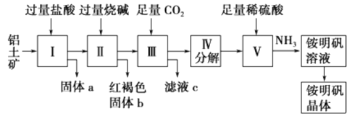
请回答下列问题:
(1)固体a的化学式为________,固体b化学式为________,Ⅲ中通入足量CO2气体发生反应的离子方程式为________________。
(2)由Ⅴ制取铵明矾溶液的化学方程式为__________________。
(3)由Ⅰ→Ⅱ→Ⅲ→Ⅳ都要用到的分离方法是__________________,由铵明矾溶液中制铵明矾晶体的操作是__________________。
(4)如果先向铝土矿加入过量氢氧化钠,再加入过量盐酸,此时首先出现的固体a是__________。
【答案】SiO2 Fe(OH)3 ![]() +CO2+2H2O===
+CO2+2H2O===![]() +Al(OH)3↓ Al2O3+4H2SO4+2NH3===2NH4Al(SO4)2+3H2O 过滤 蒸发浓缩、冷却结晶、过滤洗涤 Fe2O3
+Al(OH)3↓ Al2O3+4H2SO4+2NH3===2NH4Al(SO4)2+3H2O 过滤 蒸发浓缩、冷却结晶、过滤洗涤 Fe2O3
【解析】
(1)铝土矿中Al2O3和Fe2O3能溶于盐酸,SiO2不溶于盐酸,所以固体a的化学式为SiO2;铝土矿中Al2O3和Fe2O3能溶于盐酸,生成铁离子和铝离子,加入过量的烧碱,铝离子变为NaAlO2溶液,反应的离子方程式为:铁离子生成氢氧化铁沉淀,所以固体b化学式为Fe(OH)3;Ⅲ中偏铝酸钠溶液通入足量CO2气体生成氢氧化铝沉淀,反应的离子方程式为AlO2- +CO2+2H2O===HCO3-+Al(OH)3↓。
综上所述,本题答案是:SiO2;Fe(OH)3;AlO2- +CO2+2H2O===HCO3-+Al(OH)3↓。
(2)根据流程可知,Al(OH)3分解生成Al2O3,Al2O3与稀硫酸、氨气反应生成铵明矾溶液,反应的化学方程式为:Al2O3+4H2SO4+2NH3===2NH4Al(SO4)2+3H2O;
综上所述,本题答案是:Al2O3+4H2SO4+2NH3===2NH4Al(SO4)2+3H2O。
(3)根据流程可知,Ⅰ→Ⅱ→Ⅲ→Ⅳ操作中都涉及到了固液分离操作,所以Ⅰ→Ⅱ→Ⅲ→Ⅳ都要用到的分离方法是过滤;从铵明矾溶液中获得铵明矾晶体的实验操作依次为蒸发浓缩、冷却结晶、过滤、洗涤。
综上所述,本题答案是:过滤 ;蒸发浓缩、冷却结晶、过滤、洗涤。
(4) 铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质),如果先向铝土矿加入过量氢氧化钠,氧化铝、二氧化硅均溶于强碱溶液生成偏铝酸钠和硅酸钠溶液,氧化铁不溶与氢氧化钠,此时首先出现的固体a是 Fe2O3;
综上所述,本题答案是:Fe2O3。


科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2·12H2O俗称铵明矾,其性质稳定,是化学实验常用的基准试剂。用碳酸氢铵与硫酸钠可以制备纯净的铵明矾,制备过程如图,下面说法不正确的是
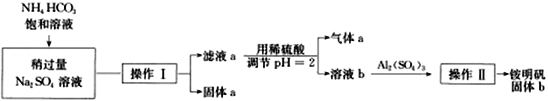
A.加入NH4HCO3饱和溶液发生反应的离子方程式:Na++HCO3-=NaHCO3↓
B.调节pH时,为了减少损耗,提高产率,可将pH试纸直接浸入滤液a中
C.操作Ⅱ的基本过程为蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D.若过量的气体a通入到饱和的纯碱溶液中会有晶体析出,该晶体与固体a相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种原子序数递增的前36号元素。X、Y是同周期元素,原子序数相差1,价电子数之和为11;Z为第三周期元素,价电子数为2;基态M原子有6个未成对电子;W属于ds区元素,有1个未成对电子。下列说法错误的是( )
A. 原子半径:Z>X>Y,电负性:Y>X>Z
B. X和Y的简单氢化物分子间均存在氢键,二者均可以作为配合物中的配体
C. Z(XY3)2晶体含离子键和共价键,酸根离子的中心原子杂化方式为sp2
D. M为ⅥB族元素,Z单质和W单质晶体的配位数均为12,空间利用率均为68%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将a g由CO和H2组成的混合气体在足量的O2中充分燃烧后,将生成的所有产物通过足量的Na2O2固体,Na2O2固体增加的质量为
A. a g B. ![]() g
g
C. ![]() g D.
g D. ![]() g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
已知:
![]()
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |

(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_____层(填上或下),分液后用____________(填入字母编号)洗涤。
a KMnO4溶液 b 稀H2SO4 c Na2CO3溶液
②再通过____________(填操作名称)即可得到精品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为______,3d能级上的未成对电子数为_______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是________。
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是______。
③氨的沸点_______(填“高于”或“低于”)膦(PH3),原因是_______;氨是______分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)铜晶体铜碳原子的堆积方式如图所示。
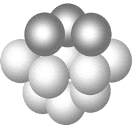
①基态铜在元素周期表中位置__________________。
②每个铜原子周围距离最近的铜原子数目_________。
(4)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如图所示(黑点代表铜原子)。
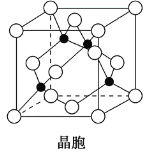
①该晶体的化学式为__________________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于________(填“离子”或“共价”)化合物。
③已知该晶体的密度为ρ g·cm-3,阿伏加德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为________pm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以溴代芳烃A为原料发生如图转化,下列说法中错误的是
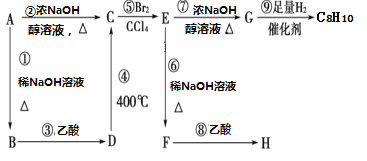
A. 合适的原料A可以有两种B. 转化中发生消去反应的是②⑦
C. C的名称为苯乙烯D. 转化中发生取代反应的是①③⑥⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯酚为原料的合成路线如下所示,请按要求作答:
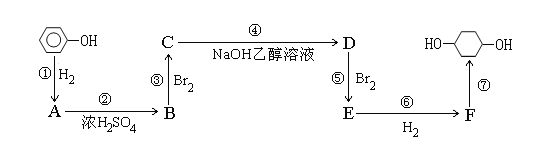
(1)写出A物质的名称:__________;步骤①至⑦中属于加成反应的是__________
(2)写出反应②④的化学反应方程式:
②__________________________________________________________________
④__________________________________________________________________
(3)反应⑤可以制得E,同时得到多种副产物,其中有一种副产物G的结构中只有3种不同的氢原子,副产物G发生图中⑦的反应生成有机物H,写出H结构简式为:__________
(4)1,3-丁二烯是应用广泛的有机化工原料,它还可以用来合成氯丁橡胶。结合以上信息写出以1,3-丁二烯为原料制备氯丁橡胶的单体![]() 的合成路线(必要的无机试剂可任选)。(示例:CH3CH2OH
的合成路线(必要的无机试剂可任选)。(示例:CH3CH2OH ![]() CH2=CH2
CH2=CH2![]() BrCH2CH2Br)___________________________
BrCH2CH2Br)___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mL浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释(溶液体积为V),溶液pH随lgV的变化情况如图所示,则下列说法正确的是( )
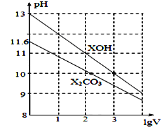
A. XOH是弱碱
B. pH=10的溶液中c(X+):XOH大于X2CO3
C. 已知CO32-的水解常数Kh1远远大于Kh2,则Kh1约为1.0×10-3.8
D. 当lgV=2时,升高X2CO3溶液温度,溶液碱性增强且c(HCO3-)/c(CO32-)减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com