
����Ŀ���ڷ���ijЩ��Һ�е����ӳɷ�ʱ��Ϊ���ų��������ӿ��ܵĸ��ţ�ͨ��������Һ�м���һЩ�Լ��Ը������ӽ����ڱ��Եõ�ȷ�Ľ���������ڱη����ͷ��������ȷ���ǣ� ��
A.ij��Һ�еμ���ˮ���ٵμ�KSCN��Һ����Ѫ��ɫ������Һ�к���Fe3+
B.ij��Һ�еμ�NaOH��Һ���ٵμ�CaCl2��Һ���ְ�ɫ����������Һ�к���CO ![]()
C.ij��Һ�еμӰ�ˮ���ٵμ�NaOH��Һ���ְ�ɫ����������Һ�к���Al3+
D.ij��Һ�еμ�����ϡ������ٵμ�BaCl2��Һ�ų��ְ�ɫ����������Һ�к���SO ![]()
���𰸡�D
���������⣺A���������ӱ���������Ϊ�����ӣ���Һ����ֺ�ɫ����Һ�в�һ�����������ӣ���A����
B����Һ�е�HCO3�������������Ʒ�Ӧ����̼������ӽ�ϸ��������ɳ���������ԭ��Һ�в�һ������̼������ӣ���B����
C����Һ�������ӺͰ�ˮ��Ӧ��������������ɫ��������������������Һ�������ܽ⣬֤���������ӣ���C����
D����Һ�м�������ϡ�����������ټ����Ȼ�����Һ���ְ�ɫ����֤��������������ӣ�����������ӵļ��鷽������D��ȷ��
��ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȷд�����з�Ӧ�Ļ�ѧ����ʽ��
��1��Al��OH��3 ������������Һ��Ӧ��
��2������������������������������
��3����������������ᷴӦ��
��4��������ʵ������ȡ����
��5��Ũ������ľ̿��Ӧ��
��6��ϡ������ͭ��Ӧ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼�����ƹ㷺��Ӧ����������ʵ����ճ������С�ij����С��ͬѧͨ���������϶�̼�����Ƶ����ʺ��Ʒ�������ϵ��ʵ�飬�������̽����
��1����NaHCO3��Һ�μ�MnCl2��Һ���ɳ���MnCO3�����ӷ���ʽΪ______��
��2����NaHCO3��Һ����������þ�ۣ��۲쵽������Ͱ�ɫ�������ɣ��������һ����______���ѧʽ������ɫ���������ǣ���MgCO3����Mg(OH)2����Mg2(OH)2CO3����֤����ɫ����Ϊ�ڣ���ʵ�鷽��Ϊ______������������ͽ��ۣ���
��3�����Na2CO3��Һ��NaHCO3��ԭ����ͼ��1��ʾ��
�ٵ����ڣ��������ܷ�Ӧ����ʽΪ______��
������������������Ĥ��Na+Ϊ 0.4 mol���������ռ��� O2_____L���������
�۵�������Һ�еĺ�̼�����٣��˽�������ӦʽΪ______��
��4�� �������Ƽ����ԭ���ǣ� NaCl+NH3+ CO2+H2O= NaHCO3+NH4Cl��ģ����Ʒ��IJ���װ����ͼ��2��ʾ��
�� ��ȷ�IJ�����______������ţ���
A��aͨ��CO2��Ȼ��bͨ��NH3��c�зż�ʯ��
B��aͨ��NH3��Ȼ��bͨ��CO2��c�з�պϡ�������֬��
C��bͨ��NH3��Ȼ��aͨ��CO2��c�зż�ʯ��
D��bͨ��CO2��Ȼ��aͨ��NH3��c�з�պϡ�������֬��
�� ˮ���е���ˮ�������ã�����������______��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ƿ�ϱ��У����¶ȡ���Ũ�ȡ�����������ѹǿ�����̶��ߡ�����ʽ���ʽ�������е�
A. �٢ۢ� B. �ۢݢ� C. �٢ڢ� D. �ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳ���CO��H2�ϳɼ״�����Ӧ����ʽΪ��
CO (g) +2H2 (g) ![]() CH3OH (g) ��H����T1��ʱ�����Ϊ2L�ĺ��������г������ʵ���֮��Ϊ3mol��H2��CO���ﵽƽ��ʱCH3OH���������(V%)��n(H2)��n(CO)�Ĺ�ϵ��ͼ1��ʾ��
CH3OH (g) ��H����T1��ʱ�����Ϊ2L�ĺ��������г������ʵ���֮��Ϊ3mol��H2��CO���ﵽƽ��ʱCH3OH���������(V%)��n(H2)��n(CO)�Ĺ�ϵ��ͼ1��ʾ��

(1)����ʼn (H2)��n(CO) =2������5min�ﵽƽ�⣬��ʱ������ѹǿ�dz�ʼѹǿ��0.7������0��5min��ƽ����Ӧ����v(H2)=____������ʱ���������м���0.15 mol CO (g)��0.05 mol CH3OH (g)������ƽ��ʱH2��ת���ʽ�_______��ѡ���������С�����䡱����
(2)����ʼn (H2)��n(CO) =3.5ʱ���ﵽƽ��״̬��CH3OH���������������ͼ���е�_____�㣨ѡ�D������E����F������
(3)��ͼ2��֪�÷�Ӧ�ġ�H_____0��ѡ�>������<����=������ͬ����ѹǿpl____p2����ѹǿΪp2ʱ����y�㣺v������____v���棩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������KMnO4��H2C2O4�����ᣩ��Ӧ�о�Ӱ�췴Ӧ���ʵ����أ����ӷ���ʽΪ��2MnO4 -+5H2C2O4+6H+=2Mn2++10CO2��+8H2O��ijʵ��С����ͨ���ⶨ��λʱ��������CO2�����ʣ�̽��ij��Ӱ�컯ѧ��Ӧ���ʵ����أ���Ʒ������£�KMnO4��Һ���ữ����
ʵ����� | A��Һ | B��Һ |
�� | 20mL 0.lmol��L-l H2C2O4��Һ | 30mL 0.01mol.L-l KMnO4��Һ |
�� | 20mL 0.2mol��L-l H2C2O4��Һ | 30mL 0.01mol.L-l KMnO4��Һ |

(1)��ʵ��̽������______�Ի�ѧ��Ӧ���ʵ�Ӱ�졣��ͬʱ������Ͳ������CO2�������С��ϵ��_____����ʵ����ţ���
(2)��ʵ�����2minĩע�����Ļ��������ƶ�����b mL��λ�ã������ʱ��ķ�Ӧ���ʿɱ�ʾΪv(CO2)=______mL/min����ʵ�����t min�ռ���4.48��10-3L CO2����״���£�����t minĩc(MnO4-)=______��
(3)��С��ͬѧ���ַ�Ӧ����������ͼ��������t1��t2ʱ�������ʱ�����Ҫԭ������ǣ���___________����___________��
(4)��֪������һ�ֶ�Ԫ���ᣬ����볣��K1=5.4��10-2��K2=5.4��10-5��д������ĵ��뷽��ʽ_______��________���Դӵ���ƽ���ƶ��ĽǶȽ���K1>>K2��ԭ��_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���ϣ�Χ����Ļ��������ʽ�������̽���������Ҫ��ش��������⣮ 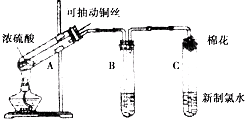
��1��װ��A�з�Ӧ�Ļ�ѧ����ʽΪ ��
��2��װ��B����̽��SO2��Ư���ԣ���Ӧװ���Լ��� �� ��Ӧһ��ʱ�������������������Cl2ͨ��B��Ҳ�ܿ���ͬ��������������ڷ�Ӧԭ���������ͬ������ͬ������
��3��װ��C����SO2�����ԣ����������ԭ������װ��C�Թܿ�����Ӧպ����Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͬŨ�ȵ���Һ���������̼��۴��ᡣ���ǵ�������ǿ������˳���ǣ� ��
A. �٢ڢ� B. �٢ۢ� C. �ڢ٢� D. �ۢڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ�ؿ���ʹ���ں���ɻ��ϣ��䷴Ӧԭ��ʾ��ͼ����ͼ�������й�����ȼ�ϵ�ص�˵����ȷ���ǣ� �� 
A.�õ�ع���ʱ����ת��Ϊ��ѧ��
B.�õ���е缫a������
C.���·�е����ɵ缫bͨ����������缫a
D.�õ�ص��ܷ�Ӧ��2H2+O2=2H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com