
【题目】化合物H是一种有机材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:

已知:①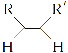
![]() RCHO+R′CHO
RCHO+R′CHO
②RCHO+R′CH2CHO![]()
![]() +H2O
+H2O
③![]()
请回答下列问题:
(1)芳香族化合物B的名称为________,1molB最多能与_____molH2加成,其加成产物等效氢共有_______种。
(2)由E生成F的反应类型为________,F分子中所含官能团的名称是_______。
(3)X的结构简式为________。
(4)写出D生成E的第①步反应的化学方程式______。
(5)G与乙醇发生酯化反应生成化合物Y,Y有多种同分异构体,其中符合下列条件的同分异构体有________种,写出其中任意一种的结构简式____。
①分子中含有苯环,且能与饱和碳酸氢钠溶液反应放出CO2;②其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1。
(6)根据题目所给信息,设计由乙醛和苯甲醛制备![]() 的合成路线(无机试剂任选)______。
的合成路线(无机试剂任选)______。
【答案】苯甲醛 4 6 加成反应 羧基、溴原子 ![]()
![]() +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH![]()
![]() +Cu2O↓+3H2O 4
+Cu2O↓+3H2O 4  (或
(或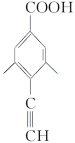 .
.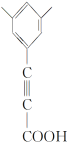 .
.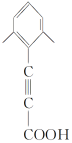 中任一种)
中任一种) 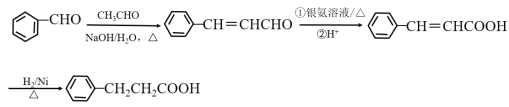
【解析】
A发生信息①中氧化反应得到B、C,而B为芳香族化合物,故B为![]() 、C为CH3CHO,B与C发生信息②中的反应生成D为
、C为CH3CHO,B与C发生信息②中的反应生成D为![]() ,D发生氧化反应得到E为
,D发生氧化反应得到E为![]() ,E与溴发生加成反应生成F为
,E与溴发生加成反应生成F为![]() ,F发生消去反应生成G为
,F发生消去反应生成G为![]() ,由H的结构,结合信息③中的加成反应,可知X为
,由H的结构,结合信息③中的加成反应,可知X为![]() 。
。
(1)根据分析可知B为![]() ,名称为苯甲醛;苯环和醛基中的碳氧双键都可以与氢气发生加成反应,所以1molB最多能与4mol氢气发生加成反应,加成后生成
,名称为苯甲醛;苯环和醛基中的碳氧双键都可以与氢气发生加成反应,所以1molB最多能与4mol氢气发生加成反应,加成后生成![]() ,有6种环境的氢原子;
,有6种环境的氢原子;
(2)E到F为碳碳双键与溴的加成反应,F为![]() ,官能团为溴原子、羧基;
,官能团为溴原子、羧基;
(3)根据分析可知X为![]() ;
;
(4)D生成E的第①步反应为新制氢氧化铜氧化醛基的反应,方程式为:![]() +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH![]()
![]() +Cu2O↓+3H2O;
+Cu2O↓+3H2O;
(5)G(![]() )与乙醇发生酯化反应生成化合物Y,则Y的分子式为C11H10O2,其同分异构体满足:
)与乙醇发生酯化反应生成化合物Y,则Y的分子式为C11H10O2,其同分异构体满足:
①分子中含有苯环,且能与饱和碳酸氢钠溶液反应放出CO2,说明含有羧基;
②其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1,说明分子结构对称,且应有两个处于对称位置的甲基,符合条件的同分异构体有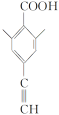 、
、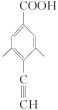 、
、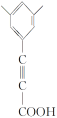 、
、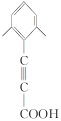 共4种;
共4种;
(6)原料为乙醛和苯甲醛,目标产物为![]() ,需要将苯甲醛的支链上的碳链加长,同时引入羧基,根据题目信息②两个醛基可以反应,加长碳链,同时保留一个醛基,将醛基氧化可以生成羧基,所以合成路线为
,需要将苯甲醛的支链上的碳链加长,同时引入羧基,根据题目信息②两个醛基可以反应,加长碳链,同时保留一个醛基,将醛基氧化可以生成羧基,所以合成路线为 。
。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】氧化铬绿(Cr2O3)的性质独特,在冶金、颜料等领域有着不可替代的地位。一种利用淀粉水热还原铬酸钠(Na2CrO4)制备氧化铬绿的工艺流程如下:
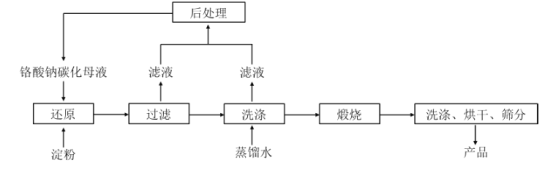
已知:①向含少量 Na2 CO3的铬酸钠碱性溶液中通入CO 2可制得不同碳化率的铬酸钠碳化母液;
②“还原”反应剧烈放热,可制得 Cr(OH) 3 浆料。
(1)铬酸钠(Na2CrO4)中铬元素的价态是________,该工艺中“还原”反应最初使用的是蔗糖或甲醛,请写出甲醛的电子式:________________,后来改用价格低廉的淀粉。请写出甲醛(HCHO)与铬酸钠(Na2CrO4)溶液反应的离子方程式___________________________ 。
(2)将混合均匀的料液加入反应釜,密闭搅拌,恒温发生“还原”反应,下列有关说法错误的是____________(填标号)。
A.该反应一定无需加热即可进行 B.必要时可使用冷却水进行温度控制
C.铬酸钠可适当过量,使淀粉充分反应 D.应建造废水回收池,回收含铬废水
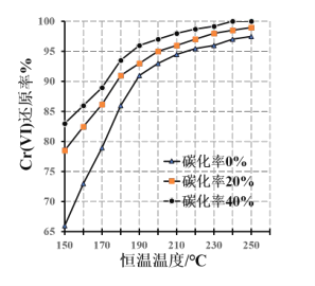
(3)测得反应完成后在不同恒温温度、不同碳化率下 Cr(Ⅵ)还原率如下图。实际生产过程中 Cr(Ⅵ)还原率可高达 99.5%以上,“还原”阶段采用的最佳反应条件为________________。
(4)滤液中所含溶质为_________________。该水热法制备氧化铬绿工艺的优点有________________ 、___(请写出两条)。
(5)重铬酸钠(Na2Cr2O7·H2O)与硫酸铵热分解法也是一种生产氧化铬绿的方法,生产过程中产生的气体对环境无害,其化学反应方程式为______________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)如图是自来水表的常见安装方式,发生腐蚀过程中,电流从_______ (填“接头流向水表”或“水表流向接头”)。

(2)某二次电池放电的电池反应为2Fe+O2+2H2O = 2Fe(OH)2。反应结束时,电极a的质量__________(填“减小”“不变”或“增加”),该电池的正极反应式为____________。

(3)有如图装置:

①图1中,用惰性电极电解过程中的实验数据如图,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中图1装置中产生气体的总体积(标准状况)。电解过程中转移n(e-)=0.4mol,b电极的实验现象为_______________;Q点时,a电极收集到的气体体积为________________。

②图2中,装置通电后,溶液仍然保持澄清,铁电极附近呈紫红色(已知FeO42-在水溶液中呈紫红色),Fe电极上发生的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的操作、现象和结论都正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向浓度均为0.10molL-1的KCl和KI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
B | 向Na2SO3溶液中先加入Ba(NO3)2溶液,然后再加入稀盐酸 | 生成白色沉淀,加入稀 盐酸,沉淀不溶解 |
|
C | 向盛有NH4Al(SO4)2溶液的试管中,滴加少量NaOH溶液 | 产生使湿润的红色石蕊试纸变蓝的气体 | NH4++OH- = NH3↑+H2O |
D | 测定等物质的量浓度的Na2CO3和NaClO的pH值 | Na2CO3>NaClO | 酸性:H2CO3<HClO |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向等物质的量浓度的K2S、KOH混合溶液中滴加稀盐酸至过量。其中主要含硫各物种(H2S、HS、S2)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出)。下列说法不正确的是
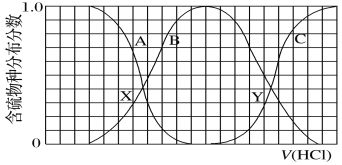
A.A曲线表示S2-随盐酸加入量增加时的分布分数改变情况
B.X、Y为曲线两交叉点。若已知Y点处的pH,则可计算Ka1(H2S)
C.X、Y点对应溶液中水的电离程度大小关系为:X<Y
D.Y点对应溶液中c(K+)与含硫各微粒浓度的大小关系为:c(K+)=3[c(H2S)+c(HS)+c(S2)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。

(1)该反应是__反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率_(填“增大”“减小”“不变”),原因是__。
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_,E2_,ΔH_(填“增大”“减小”“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对有关文献的理解错误的是
A. 《汉书》中“高奴县有洧水可燃”,《梦溪笔谈》对“洧水”的使用有“试扫其烟为墨,黑光如漆,松墨不及也”的描述,其中的烟指炭黑
B. 《物理小识》记载“青矾(绿矾)厂气熏人,衣服当之易烂,栽木不茂”,青矾厂气是CO和CO2
C. 《本草纲目》描述“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”其中的碱是K2CO3
D. 《天工开物》记裁制造青瓦“(窑)泥周寒其孔,浇水转釉”,红瓦转化为青瓦的原因是Fe2O3转化为其他铁的氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式硫酸铬[Cr(OH)SO4nH2O]常用于鞣制皮革,染料工业的活性黑染料、媒染剂。电镀废水中(主要含Cr2O72-、Cr3+、Fe3+、CN-、Cl-,少量Mg2+、Cu2+等离子),提取含铬废水中的铬并制成可用的碱式硫酸铬对污染治理和工业生产具有十分重要的意义。
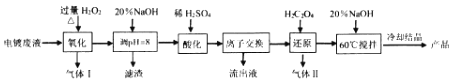
相关金属离子[co (Mn+)= 01 molL-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Cr3+ | Fe3+ | Mg2+ | Cu2+ |
开始沉淀的pH | 4.3 | 1.9 | 9.1 | 4.7 |
沉淀完全的pH | 5.6 | 3.2 | 11.1 | 6.7 |
回答下列问题:
(1)碱式硫酸铬中Cr的化合价为_________。
(2)“氧化”时需控制反应温度在50℃~90℃,原因___________。H2O2先将CN-氧化为无害气体除去,气体I成分是________;后在碱性条件下将Cr3+ 氧化为CrO42-,滤渣中主要含________ (填相关物质的化学式)。
(3)“酸化”时CrO42-可转化为Cr2O72-,其离子方程式为________。
(4)“离子交换”过程采用钠离子交换树脂,反应原理为Mn+ +nNaR=MRn+nNa+ ,则富集到钠离子交换树脂上的金属阳离子有_________(填离子符号)。
(5)处理1L0.1molL-1Cr2O72- 的废水,理论上需要H2C2O4的物质的量为_______ mol。
(6)废水中含有的Cl-常以K2CrO4溶液为指示剂,用AgNO3标准溶液滴定测其含量,利用Ag+与CrO42-生成的砖红色沉淀指示到达滴定终点。当溶液中Cl- 恰好完全沉淀(浓度等于1.0×10一5molL-1)时,溶液中c (Ag+)为_____molL-1 此时溶液中c(CrO42-)等于_______mo1L-1(已知Ag2CrO4、AgCl的Ksp分别约为2.0×10-12和和2.0×10 -10)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间以单键结合。下列有关C3N4晶体的说法中错误的是
![]()
A.C3N4晶体与金刚石都属于原子晶体
B.C3N4晶体中C-N键的键长比金刚石中的C-C键的键长长
C.C3N4晶体中每个碳原子连接4个氮原子,每个氮原子连接3个碳原子
D.C3N4晶体中含有极性共价键,不含非极性共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com