
【题目】月球上的每百吨He聚变所释放出的能量相当于目前人类一年消耗的能量,地球上氦元素主要以He的形式存在。已知一个12C原子的质量为a g,一个He原子的质量为b g,NA为阿伏加德罗常数。下列说法正确的是
A.He比H多一个中子B.氦元素的近似相对原子质量为3
C.He的相对原子质量为![]() D.He的摩尔质量为bNA
D.He的摩尔质量为bNA
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
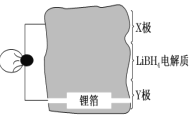
【题目】(1)全固态锂离子电池的结构如图所示,放电时电池反应为 2Li+MgH2=Mg+2LiH。放电时,X 极作_________极。充电时,Y 极反应式为___________。
(2)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子)。
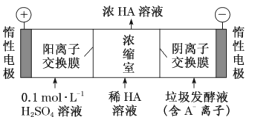
①阳极的电极反应式为 ________________
②简述浓缩室中得到浓乳酸的原理:________________
③电解过程中,采取一定的措施可控制阳极室的 pH 约为 6~8,此时进入浓缩室的OH-可忽略不计。400 mL 10 gL 1 乳酸溶液通电一段时间后,浓度上升为 145 gL 1 (溶液体积变化忽略不计),阴极上产生的 H2 在标准状况下的体积约为_____________L。(乳酸的摩尔质量为90 gmol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业中很多重要的原料都是来源于石油化工,回答下列问题
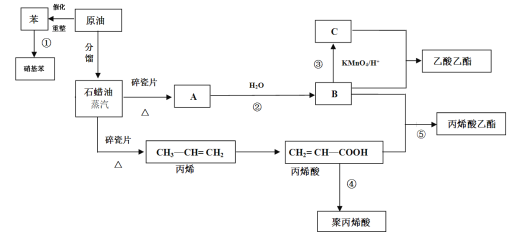
(1)C的结构简式为________。
(2)③④反应的反应类型分别为_____________、___________。
(3)丙烯酸(CH2 = CH — COOH)可能发生的反应有____________(填序号)
A 加成反应 B 取代反应 C 加聚反应 D 中和反应 E 氧化反应
(4)写出下列反应方程式
①反应①的化学方程式__________________________________________________;
②反应②的化学方程式__________________________________________________;
③反应⑤的化学方程式__________________________________________________。
(5)丙烯分子中最多有______个原子共面。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代膜技术可使某种离子具有单向通过能力,常用于电解池、原电池中。电解NaB(OH)4溶液可制备H3BO3,其工作原理如图。下列叙述错误的是( )
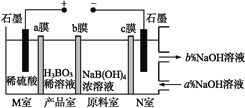
A. M室发生的电极反应式:2H2O-4e-![]() O2↑+4H+
O2↑+4H+
B. N室:a<b
C. 产品室发生的反应是B(OH)4- +H+![]() H3BO3+H2O
H3BO3+H2O
D. 理论上每生成1 mol产品,阴极室可生成标准状况下5.6 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是合成抗炎药洛索洛芬钠的关键中间体,它的一种合成路线如下:
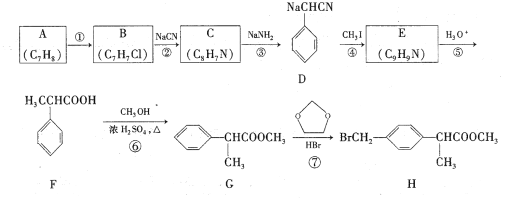
回答下列问题:
(1)A的名称是____,H中官能团名称是____;
(2)反应①的反应条件为____;
(3)反应⑥的化学方程式为________;反应类型为____。
(4)反应⑦除生成H外,还生成了另一种有机产物的结构简式为____。
(5)符合下列条件的G的同分异构体有____种。
I.能发生银镜反应 Ⅱ.苯环上一氯取代物只有一种 Ⅲ.核磁共振氢谱有4组峰
(6)仿照H的合成路线,设计一种由B合成![]() 的合成路线___。
的合成路线___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.苯酚与乙醇的官能团都是羟基
B.炔烃的官能团是碳碳双键
C.官能团是反应一类化合物物理性质的原子或原子团
D.饱和一元羧酸的通式为CnH2n+2O2E. 饱和一元羧酸的通式为CnH2n+2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳链增长的反应是有机合成一个重要方法,其中一个重要的反应如图:

(1)有机物A的含氧官能团名称是__;有机物B的分子式是__;
(2)按要求写出有机物A的所有同分异构体:有苯环,和A有相同的官能团__;
(3)有机物C和乙醇反应的化学方程式为(不要求写反应条件)__;
(4)有机物B其中一种制备方法如图:
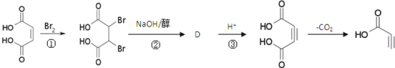
①反应①的反应类型是__;
②写出反应②的化学方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图装置加以必要的导线连接后达到粗铜精炼的目的。
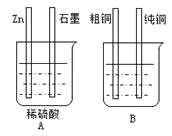
⑴A烧杯是________________(填〝电解池〞或〝原电池〞),
B烧杯是________________(填〝电解池〞或〝原电池〞)。
⑵其中Zn接B烧杯中的___________,(填“粗铜”或“纯铜”),B烧杯中应该盛____________溶液。
⑶分别写出石墨棒和纯铜棒的电极反应式
石墨棒:____________________________________,
纯铜棒:____________________________________。
⑷若锌减少了0.65 g,则纯Cu的质量增加了________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石经处理后得到明矾(KAl(SO4)2·12H2O)。由明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
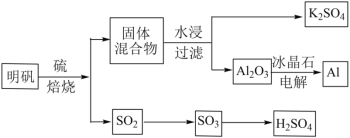
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂和还原剂的物质的量之比为_______。
(2)从水浸后的滤液中得到K2SO4晶体的操作方法是_______。
(3)A12O3在一定条件下可制得AIN,AlN的晶体结构与金刚石相似,晶胞结构如图所示。每个晶胞中含有_______个铝原子,若Al与N原子最近距离为apm,则该晶体的密度为_______g/cm3。(阿伏加德罗常数用NA表示)
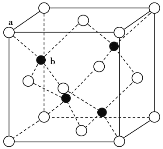
(4)SO2分子的空间构型为_______
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101kPa时
2SO2(g)+O2(g)![]() 2SO3(g)△H1=一197kJ/mol;
2SO3(g)△H1=一197kJ/mol;
2H2O(g)=2H2O(1)△H2=一44kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com