
【题目】用下图装置加以必要的导线连接后达到粗铜精炼的目的。
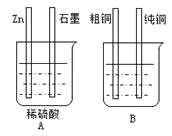
⑴A烧杯是________________(填〝电解池〞或〝原电池〞),
B烧杯是________________(填〝电解池〞或〝原电池〞)。
⑵其中Zn接B烧杯中的___________,(填“粗铜”或“纯铜”),B烧杯中应该盛____________溶液。
⑶分别写出石墨棒和纯铜棒的电极反应式
石墨棒:____________________________________,
纯铜棒:____________________________________。
⑷若锌减少了0.65 g,则纯Cu的质量增加了________g。
【答案】原电池 原解池 纯铜 CuSO4或其它易溶性的铜盐 2H++2e-=H2↑ Cu2++2e-=Cu 0.64
【解析】
(1)根据原电池和电解池的构成条件来分析;
(2)电解精炼铜时,电解质溶液是含有铜离子的盐;
(3)根据电解池和原电池的工作原理来书写电极反应;
(4)根据电极反应和电子守恒来计算。
(1)A烧杯含有两个活泼性不同的电极,有自发的氧化还原反应,形成了闭合回路,存在电解质溶液,属于原电池装置,B烧杯就存在了外加电源,属于电解装置;
因此,本题正确答案是:原电池;电解池;
(2)电解精炼铜时,粗铜做阳极,与电源的正极相连,纯铜做阴极,与电源的负极相连;电解质溶液必须是含有铜离子的可溶性的盐,如硫酸铜溶液或其它易溶性的铜盐等;
因此,本题正确答案是: 纯铜;CuSO4或其它易溶性的铜盐;
(3)石墨棒是原电池的正极,发生电极反应为: 2H++2e-=H2↑;纯铜棒是电解池的阴极,
电极反应为: Cu2++2e-=Cu;
因此,本题正确答案是: 2H++2e-=H2↑;Cu2++2e-=Cu;
(4)在A烧杯中,金属锌电极发生的电极反应为:Zn-2e-=Zn,若锌减少了0.65 g即0.01mol时,转移电子为0.02mol,在B烧杯中,纯铜电极发生的反应为: Cu2++2e-=Cu,当转移0.02mol电子时,则析出金属Cu的物质的量为0.01mol,质量为0.64g;
因此,本题正确答案是:0.64。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法或表示法正确的是( )
A. 由“C(s,石墨)→C(s,金刚石)△H=+119kJ·mol-1”可知金刚石比石墨稳定
B. 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O (1) △H=-285.8kJ·mol-1
C. 在101kPa时,1mol碳燃烧所放出的热量为碳的燃烧热
D. 等量的磷蒸气和磷固体分别完全燃烧,前者放出的热量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】月球上的每百吨He聚变所释放出的能量相当于目前人类一年消耗的能量,地球上氦元素主要以He的形式存在。已知一个12C原子的质量为a g,一个He原子的质量为b g,NA为阿伏加德罗常数。下列说法正确的是
A.He比H多一个中子B.氦元素的近似相对原子质量为3
C.He的相对原子质量为![]() D.He的摩尔质量为bNA
D.He的摩尔质量为bNA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2) = 5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3) = 3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T℃条件下,向lL固定体积的密闭容器M中加入2molX和lmolY,发生如下反应:2X(g)+Y(g)![]() aZ(g)+W(g) ΔH=-QkJ·mol-1(Q>0)。当反应达到平衡后,放出的热量为Q1kJ。若平衡后再升高温度,混合气体的平均相对分子质量减小。维持温度T℃不变,若起始时向容器M中加入物质的物质的量如下,则反应达到平衡后放出的热量仍为Q1kJ的是( )
aZ(g)+W(g) ΔH=-QkJ·mol-1(Q>0)。当反应达到平衡后,放出的热量为Q1kJ。若平衡后再升高温度,混合气体的平均相对分子质量减小。维持温度T℃不变,若起始时向容器M中加入物质的物质的量如下,则反应达到平衡后放出的热量仍为Q1kJ的是( )
A.2molX、1molY、1molAr
B.amolZ、1molW
C.1molX、0.5molY、0.5amolZ、0.5molW
D.2molX、1molY、1molZ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
元素 | 相关信息 |
X | X原子的L层电子数是K层电子数的2倍 |
Y | Y原子的最外层电子排布式为:nsnnpn+2 |
Z | Z存在质量数为23,中子数为12的原子核 |
W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(1)W位于元素周期表第_____周期第______族,其原子最外层有____个电子。
(2)X的活泼性比Y的_____(填“强”或“弱”);X和Y的气态氢化物中,较稳定的是____(写化学式)。
(3)写出Z2Y2的电子式________________,XY2的结构式__________________。
(4)在X原子与氢原子形成的多种分子中,有些分子的核磁共振氢谱显示有两种氢,写出其中一种分子的名称______________。氢元素、X、Y的原子也可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示某硅氧离子的空间结构示意图(虚线不表示共价键)。通过观察分析,下列叙述正确的是( )
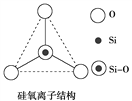
A. 键角为120° B. 化学组成为SiO![]()
C. Si原子采用sp2轨道杂化方式 D. 化学组成为SiO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZulemaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( )
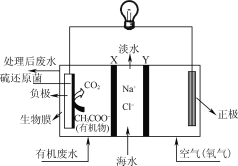
A. 该装置可以在高温下工作
B. X、Y依次为阳离子、阴离子选择性交换膜
C. 负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
D. 该装置工作时,电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图装置(夹持装置略)制备高效水处理剂高铁酸钾(K2FeO4)并探究其性质。
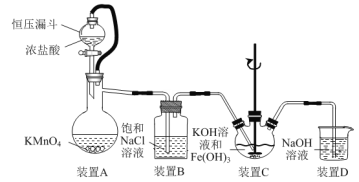
已知K2FeO4具有下列性质:①可溶于水,微溶于浓KOH溶液;②在0℃~5℃、强碱性溶液中比较稳定,在Fe(OH)3或Fe3+催化下发生分解;③在弱碱性至酸性条件下,能与水反应生成O2和Fe(OH)3(或Fe3+)。
(1)装置A用于制取氯气,其中使用恒压漏斗的原因是____。
(2)为防止装置C中K2FeO4分解,可以采取的措施是____和____。
(3)装置C中生成K2FeO4反应的离子方程式为____。
(4)用一定量的K2FeO4处理饮用水,测得产生O2的体积随时间的变化曲线如图所示。t1 s~t2 s内,O2的体积迅速增大的主要原因是____。
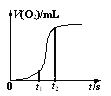
(5)验证酸性条件下氧化性FeO42->Cl2的实验方案为:取少量K2FeO4固体于试管中,____。(实验中须使用的的试剂和用品有:浓盐酸,NaOH溶液、淀粉KI试纸、棉花)
(6)根据K2FeO4的制备实验得出:氧化性Cl2>FeO42-,而第(5)小题实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com