
【题目】如图所示某硅氧离子的空间结构示意图(虚线不表示共价键)。通过观察分析,下列叙述正确的是( )
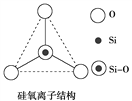
A. 键角为120° B. 化学组成为SiO![]()
C. Si原子采用sp2轨道杂化方式 D. 化学组成为SiO![]()
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案科目:高中化学 来源: 题型:
【题目】铝具有较强的抗腐蚀能力(即耐腐蚀)的主要原因是
A. 铝化学性质很稳定(即很不活泼) B. 铝与氧气在常温下很难反应
C. 铝是两性元素(因与酸、碱都能反应) D. 铝易氧化形成一层致密氧化膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. MnO2与浓盐酸混合加热:MnO2+4H++2Cl﹣![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B. 大理石与盐酸反应:CO32﹣+2H+ = H2O+CO2↑
C. 向醋酸溶液中滴加NaOH溶液:OH-+H+![]() H2O
H2O
D. 漂白粉溶液吸收二氧化碳:Ca2++ CO2+ H2O = CaCO3↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5。
则下列有关比较中正确的是( )
A. 电负性:④>③>②>① B. 原子半径:④>③>②>①
C. 第一电离能:④>③>②>① D. 最高正化合价:④>③=②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列说法正确的是( )
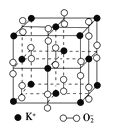
A. 超氧化钾的化学式为KO2,每个晶胞含14个K+和13个O
B. 晶体中每个K+周围有8个O,每个O周围有8个K+
C. 晶体中与每个K+距离最近的K+有8个
D. 晶体中0价氧原子与-2价氧原子的数目比为3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的( )
①常温常压下,11.2 L乙烷所含的分子数为0.5NA
②14.2g 硫酸钠固体中含有0.1NA个硫酸钠分子:
③常温下,21gC3H6和C4H8的混合物中含有的碳原子数为1.5NA
④2gD216O中含有的质子数、中子数、电子数均为NA
⑤标准状况下,由H2O2分解制得4.48LO2转移的电子数目为0.2NA
⑥10ml 18mol/L 的浓硫酸与足量的镁反应时转移的电子数为0.18NA
A. ③④ B. ①⑥ C. ④⑤⑥ D. ①②⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com