
【题目】X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
元素 | 相关信息 |
X | X原子的L层电子数是K层电子数的2倍 |
Y | Y原子的最外层电子排布式为:nsnnpn+2 |
Z | Z存在质量数为23,中子数为12的原子核 |
W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(1)W位于元素周期表第_____周期第______族,其原子最外层有____个电子。
(2)X的活泼性比Y的_____(填“强”或“弱”);X和Y的气态氢化物中,较稳定的是____(写化学式)。
(3)写出Z2Y2的电子式________________,XY2的结构式__________________。
(4)在X原子与氢原子形成的多种分子中,有些分子的核磁共振氢谱显示有两种氢,写出其中一种分子的名称______________。氢元素、X、Y的原子也可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式________________。
【答案】四 Ⅷ 2 弱 H2O ![]() O =C=O 丙烷(或丙炔或2-甲基丙烯或1,2,4,5-四甲基苯等) CH3COOH+HCO3-=CH3COO-+H2O+CO2↑
O =C=O 丙烷(或丙炔或2-甲基丙烯或1,2,4,5-四甲基苯等) CH3COOH+HCO3-=CH3COO-+H2O+CO2↑
【解析】
X的基态原子L层电子数是K层电子数的2倍,则X是碳元素;Y的基态原子最外层电子排布式为:nsnnpn+2,则n=2,所以Y是氧元素;Z存在质量数为23,中子数为12的核素,则质子数是11,是钠元素;W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色,则W是Fe元素。
(1)W是Fe元素,位于元素周期表第四周期Ⅷ族,原子最外层有2个电子,故答案为:四;Ⅷ;2;
(2)X为C元素,Y为O元素,同周期元素从左到右非金属性依次增强,则非金属性C <O,元素的非金属性越强,气态氢化物稳定性越强,则较稳定的是H2O,故答案为:<;H2O‘
(3)Z2Y2为Na2O2,Na2O2是由钠离子和过氧根离子形成的离子化合物,电子式为![]() ;XY2为CO2,CO2为含有两个碳氧双键的共价化合物,结构式为O =C=O,故答案为:
;XY2为CO2,CO2为含有两个碳氧双键的共价化合物,结构式为O =C=O,故答案为:![]() ;O =C=O;
;O =C=O;
(4)烃分子中含有两种氢原子的烃较多,如丙烷(CH3CH2CH3)、正丁烷(CH3CH2CH2CH3)、丙炔(CH3C≡CH)等,由C、H、O三种元素形成的分子很多,但形成的无机阴离子只有HCO3-,和HCO3-反应的分子必须为羧酸,如CH3COOH等,乙酸与碳酸氢根反应生成乙酸根、二氧化碳和水,反应的离子方程式为CH3COOH+HCO3-=CH3COO-+H2O+CO2↑,故答案为:丙烷(或丙炔或2-甲基丙烯或1,2,4,5-四甲基苯等);CH3COOH+HCO3-=CH3COO-+H2O+CO2↑。


科目:高中化学 来源: 题型:
【题目】(1)一定温度下,在容积为V L的密闭容器中进行反应:aN(g)![]() bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:

①此反应的化学方程式中a :b=__________
②t1到t2时刻,以M的浓度变化表示的平均反应速率为:_________________
③下列叙述中能说明上述反应达到平衡状态的是______________
A.反应中M与N的物质的量之比为1︰1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
(2)如图是某锌锰干电池的基本构造图。
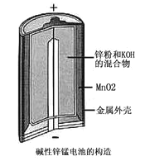
①该干电池的总反应式为2MnO2+Zn+2H2O=2MnO(OH)+ Zn(OH)2,该电池的负极是___________,工作时正极的电极反应式是______________________________。
②关于该电池的使用和性能,下列说法正确的是____________
A.该电池属于蓄电池
B.电池工作时OH-向负极移动
C.该电池的电解质溶液是H2SO4溶液
D.该电池用完后可随意丢弃,不需要回收处理
(3)另一种常用的电池锂电池由于比容量(单位质量电极材料所能转换的电量)特别大而广泛用于心脏起搏器,它的负极材料用金属锂制成,电解质溶液需用非水溶液配制,请用化学方程式表示不能用水溶液的原因_______________________________。
(4)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一氢氧燃料电池,以电极a为正极,电极b为负极,采用氢氧化钠溶液为电解液,则氧气应通入_________极(填序号),电解质溶液的pH将____________(填“变大”,“变小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.苯酚与乙醇的官能团都是羟基
B.炔烃的官能团是碳碳双键
C.官能团是反应一类化合物物理性质的原子或原子团
D.饱和一元羧酸的通式为CnH2n+2O2E. 饱和一元羧酸的通式为CnH2n+2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:

已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42—。请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作中所用的玻璃仪器是___________,步骤②得到硫酸亚铁晶体的操作为蒸发浓缩、______________。
(2)步骤④的离子方程式是_______________。
(3)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及_______。
(4)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为________。
(5)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因________。
(6)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 molL-1KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图装置加以必要的导线连接后达到粗铜精炼的目的。
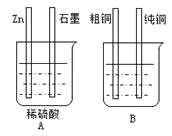
⑴A烧杯是________________(填〝电解池〞或〝原电池〞),
B烧杯是________________(填〝电解池〞或〝原电池〞)。
⑵其中Zn接B烧杯中的___________,(填“粗铜”或“纯铜”),B烧杯中应该盛____________溶液。
⑶分别写出石墨棒和纯铜棒的电极反应式
石墨棒:____________________________________,
纯铜棒:____________________________________。
⑷若锌减少了0.65 g,则纯Cu的质量增加了________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家利用CH4燃料电池(如图)作为电源,用Cu-Si合金作硅源电解制硅可以降低制硅成本,高温利用三层液熔盐进行电解精炼,下列说法不正确的是( )
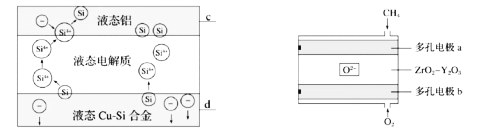
A.电极d与b相连,c与a相连
B.电解槽中,Si优先于Cu被氧化
C.a极的电极反应为CH4-8e-+8OH-=CO2+6H2O
D.相同时间下,通入CH4、O2的体积不同,会影响硅的提纯速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】西瓜膨大剂别名氯吡苯脲,是经过国家批准的植物生长调节剂,实践证明长期使用对人体无害。已知其相关性质如下表所示:
分子式 | C12H10ClN3O |
结构简式 |
|
外观 | 白色结晶粉末 |
熔点 | 170~172℃ |
溶解性 | 易溶于水 |
(1)氯吡苯脲晶体中,氮原子的杂化方式为___。
(2)两种组成均为CoCl3·4NH3的配合物分别呈绿色和紫色。已知绿色的配合物内界结构对称,请在图a和图b中用元素符号标出氯原子的位置___、___。
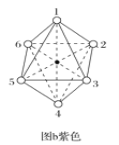
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置检验对应气体时,不能达到目的是
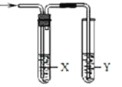
(X—除杂装置、Y—检验装置)
实验目的 | 试剂X | 试剂Y | |
A | 检验溴蒸汽中混有的NO2 | CCl4试剂 | 石蕊试液 |
B | 检验HI中混有的HCl | 饱和NaCl溶液 | AgNO3溶液 |
C C | 浓盐酸与MnO2共热制取的氯气 | NaOH溶液 | 淀粉KI溶液 |
D | C2H5OH与浓H2SO4加热至170℃制取的乙烯 | NaOH溶液 | Br2的CCl4溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛能够发生下列反应:
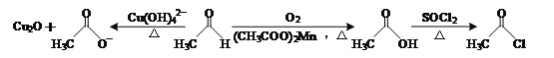
(1)Mn2+的基态电子排布式为____。
(2)氯化亚砜(SOCl2)是有机合成中重要的氯化剂,与SOCl2互为等电子体的阴离子的化学式为____。
(3)CH3CHO分子中碳原子的轨道杂化类型是____。
(4)乙酸的沸点(117.9 ℃)比乙醛的沸点(20.8 ℃)高的主要原因是____。
(5)不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为____。
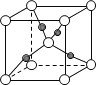
(6)如图表示Cu2O的晶胞,Cu+的配位数是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com