
【题目】利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:

已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42—。请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作中所用的玻璃仪器是___________,步骤②得到硫酸亚铁晶体的操作为蒸发浓缩、______________。
(2)步骤④的离子方程式是_______________。
(3)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及_______。
(4)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为________。
(5)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因________。
(6)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 molL-1KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示)____________。
【答案】玻璃棒、烧杯、漏斗 冷却结晶、过滤、洗涤、干燥 Fe2++2HCO3-=FeCO3↓+H2O+CO2↑ 防止Fe2+被氧化 1: 4 硫酸亚铁在溶液中存在如下平衡FeCO3(s)![]() Fe2+(aq)+ CO32-(aq),CO32-与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液
Fe2+(aq)+ CO32-(aq),CO32-与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液 ![]() ×100%
×100%
【解析】
废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,加铁屑,Fe与H2SO4和少量Fe2(SO4)3反应生成FeSO4,TiOSO4水解生成TiO2xH2O,过滤,滤渣为TiO2xH2O、Fe,滤液为FeSO4;FeSO4溶液通过蒸发浓缩、冷却结晶、过滤洗涤得到硫酸亚铁晶体,脱水、煅烧得到氧化铁;FeSO4溶液中加如碳酸氢铵,反应生成碳酸亚铁沉淀、硫酸铵和二氧化碳,碳酸亚铁沉淀加乳酸,碳酸亚铁溶解生成乳酸亚铁溶液和二氧化碳,乳酸亚铁溶液通过蒸发浓缩、冷却结晶、过滤洗涤得到乳酸亚铁晶体。
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作为过滤,过滤用的仪器有玻璃棒、烧杯、漏斗;步骤②得到硫酸亚铁晶体的操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:玻璃棒、烧杯、漏斗;冷却结晶、过滤、洗涤、干燥;
(2)步骤④的反应为FeSO4与如碳酸氢铵反应生成碳酸亚铁沉淀、硫酸铵和二氧化碳,反应的离子方程式是Fe2++2HCO3-=FeCO3↓+H2O+CO2↑,故答案为:Fe2++2HCO3-=FeCO3↓+H2O+CO2↑;
(3)Fe2+具有还原性,步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及隔绝空气,防止Fe2+被氧化,故答案为:防止Fe2+被氧化;
(4)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,反应的方程式为4FeSO4+ O2 ![]() 4SO3+ 2 Fe2O3,由化合价变化可知,氧化剂为O2和还原剂为FeSO4,由得失电子数目守恒可知氧化剂和还原剂的物质的量之比为1: 4,故答案为:1:4;
4SO3+ 2 Fe2O3,由化合价变化可知,氧化剂为O2和还原剂为FeSO4,由得失电子数目守恒可知氧化剂和还原剂的物质的量之比为1: 4,故答案为:1:4;
(5)硫酸亚铁在溶液中存在如下平衡FeCO3(s)![]() Fe2+(aq)+ CO32-(aq),加入乳酸,CO32-与乳酸反应,使CO32-浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液,故答案为:硫酸亚铁在溶液中存在如下平衡FeCO3(s)
Fe2+(aq)+ CO32-(aq),加入乳酸,CO32-与乳酸反应,使CO32-浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液,故答案为:硫酸亚铁在溶液中存在如下平衡FeCO3(s)![]() Fe2+(aq)+ CO32-(aq),CO32-与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液;
Fe2+(aq)+ CO32-(aq),CO32-与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液;
(6)亚铁离子会被高锰酸钾氧化为三价铁离子,本身被还原为+2价的锰离子,根据得失电子守恒可知5FeSO4·7H2O—KMnO4,则依据消耗0.1000mol/LKMnO4溶液20.00mL可知FeSO4·7H2O的质量分数为![]() ×100% =
×100% =![]() ×100%,故答案为:
×100%,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)连二次硝酸中氮元素的化合价为_____________________。
(2)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。
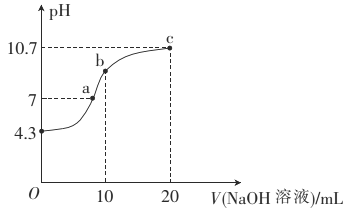
①写出H2N2O2在水溶液中的电离方程式:______________。
②b点时溶液中c(H2N2O2)_____(填“>”、“<”或 “=”,下同)c(N2O22-)。
③a点时溶液中c(Na+)____c(HN2O2-)+c(N2O22-)。
(3)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中![]() =______。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
=______。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-选修3:物质结构与性质】张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
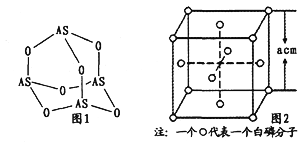
(1)N、P、As原子的第一电离能由大到小的顺序为_______;As原子的核外电子排布式为______________。
(2)NH3的沸点比PH3_____(填“高"或“低”),原因是_____________。
(3)Na3AsO4中含有的化学键类型包括_______;AsO43-的空间构型为_______,As4O6的分子结构如图1所示,则在该化合物中As的杂化方式是_________。
(4)白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小圆圈表示白磷分子)。己知晶胞的边长为acm,阿伏加德罗常数为NAmol-1,则该晶胞中含有的P原子的个数为______,该晶体的密度为___g·cm-3(用含NA、a的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜和镁的合金2.3 g完全溶于浓HNO3,若反应中硝酸被还原只产生2.240 L的NO2气体和168 mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生产沉淀的质量为
A.4.1275 gB.4.255 gC.8.51 gD.9.62 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2) = 5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3) = 3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知H2S的燃烧热ΔH=-akJ·mol-1,写出表示H2S燃烧反应的热化学方程式__,表示H2S燃烧热的热化学方程式__。
(2)若将FeCl3溶液蒸干灼烧,最后得到的固体产物主要是__(填化学式)。FeCl3水溶液呈__(填“酸”、“中”、“碱”)性,原因为:__(用离子方程式表示)。
(3)炒过菜的铁锅未及时洗净(残液中有NaCl),第二天便会被腐蚀而出现红褐色铁锈,试回答:铁锅的腐蚀属于电化腐蚀,其原因是__。此时铁锅锈蚀主要是吸氧腐蚀,电极反应方程式为:负极:__,正极__。
(4)估计下列各变化过程是熵增加还是熵减小。(用A、B、C填空)
NH4NO3爆炸:2NH4NO3(s)=2N2(g)+4H2O(g)+O2(g)__
水煤气转化:CO(g)+H2O(g)=CO2(g)+H2(g)__
臭氧的生成:3O2(g)=2O3(g)__
A.熵增大 B.熵减小 C.熵变很小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
元素 | 相关信息 |
X | X原子的L层电子数是K层电子数的2倍 |
Y | Y原子的最外层电子排布式为:nsnnpn+2 |
Z | Z存在质量数为23,中子数为12的原子核 |
W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(1)W位于元素周期表第_____周期第______族,其原子最外层有____个电子。
(2)X的活泼性比Y的_____(填“强”或“弱”);X和Y的气态氢化物中,较稳定的是____(写化学式)。
(3)写出Z2Y2的电子式________________,XY2的结构式__________________。
(4)在X原子与氢原子形成的多种分子中,有些分子的核磁共振氢谱显示有两种氢,写出其中一种分子的名称______________。氢元素、X、Y的原子也可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与我们的生活密切相关,请回答:
(1)在生活中要注意饮食平衡,蛋白质属于_______(填序号,下同)食物,番茄属于______食物;①酸性 ②碱性
(2)有四种常见药物①阿司匹林、②青霉素、③胃舒平、④麻黄碱. 某同学胃酸过多,应该服用______(填序号,下同);从用药安全角度考虑,使用前要进行皮肤敏感性测试的是_____;由于具有兴奋作用,国际奥委会严禁运动员服用的是_________;
(3)苹果汁是人们喜爱的饮品,由于其中含有Fe2+,现榨的苹果汁在空气中会由浅绿色变为棕黄色,若榨汁时加入维生素C,可有效防止这种现象发生.这说明维生素C具有________(填序号);①氧化性 ②还原性 ③碱性 ④酸性
(4)食用植物油进入人体后,在酶的作用下水解为高级脂肪酸和_________(写名称),进而被氧化成二氧化碳和水并提供能量,或作为合成人体所需其他物质的原料;
(5)硫酸亚铁可用于治疗缺铁性贫血,某贫血患者每天须补充1.4g铁元素,则服用的药物中含硫酸亚铁的质量至少为_________g;
(6)氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(﹣NH2)和____(写结构简式或名称).人体中共有二十多种氨基酸,其中人体自身________(填“能”或“不能”)合成的氨基酸称为人体必需氨基酸;
(7)淀粉在淀粉酶的作用下最终水解为葡萄糖(C6H12O6),部分葡萄糖在体内被氧化生成二氧化碳和水.写出葡萄糖在体内被氧化的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物吗替麦考酚酯有强大的抑制淋巴细胞增殖的作用,可通过如下反应制得:
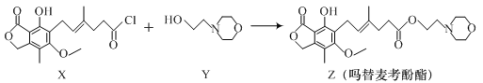 +HCl
+HCl
下列叙述正确的是
A.化合物X与溴水反应的产物中含有2个手性碳原子
B.化合物Y的分子式为C6H12NO2
C.1mol化合物Z最多可以与2molNaOH反应
D.化合物Z能与甲醛发生聚合反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com