
【题目】实验室用如图装置(夹持装置略)制备高效水处理剂高铁酸钾(K2FeO4)并探究其性质。
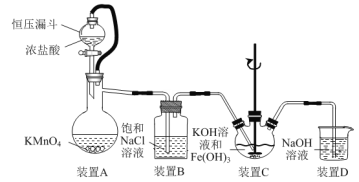
已知K2FeO4具有下列性质:①可溶于水,微溶于浓KOH溶液;②在0℃~5℃、强碱性溶液中比较稳定,在Fe(OH)3或Fe3+催化下发生分解;③在弱碱性至酸性条件下,能与水反应生成O2和Fe(OH)3(或Fe3+)。
(1)装置A用于制取氯气,其中使用恒压漏斗的原因是____。
(2)为防止装置C中K2FeO4分解,可以采取的措施是____和____。
(3)装置C中生成K2FeO4反应的离子方程式为____。
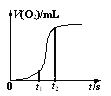
(4)用一定量的K2FeO4处理饮用水,测得产生O2的体积随时间的变化曲线如图所示。t1 s~t2 s内,O2的体积迅速增大的主要原因是____。
(5)验证酸性条件下氧化性FeO42->Cl2的实验方案为:取少量K2FeO4固体于试管中,____。(实验中须使用的的试剂和用品有:浓盐酸,NaOH溶液、淀粉KI试纸、棉花)
(6)根据K2FeO4的制备实验得出:氧化性Cl2>FeO42-,而第(5)小题实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是____。
【答案】防止因反应过于剧烈而使液体无法滴落 将装置C置于冰水浴中 KOH应过量(或减缓通入氯气的速率等) 3Cl2+2Fe(OH)3+10OH-=2FeO42-+6Cl-+8H2O K2FeO4与水发生反应生成的Fe(OH)3具有催化作用 向其中滴加少量浓盐酸,将湿润的淀粉KI试纸靠近试管口,若试纸变蓝,则说明有Cl2生成,同时说明氧化性FeO42->Cl2 溶液的酸碱性影响物质的氧化性强弱
【解析】
利用高锰酸钾与浓盐酸反应制得氯气,将氯气通过饱和氯化钠溶液除去氯化氢,纯净的氯气通入含有Fe(OH)3的KOH溶液中,制备高效水处理剂高铁酸钾(K2FeO4),用氢氧化钠溶液处理尾气,防止多余的氯气排放到空气中引起污染,据此分析。
利用高锰酸钾与浓盐酸反应制得氯气,将氯气通过饱和氯化钠溶液除去氯化氢,纯净的氯气通入含有Fe(OH)3的KOH溶液中,制备高效水处理剂高铁酸钾(K2FeO4),用氢氧化钠溶液处理尾气,防止多余的氯气排放到空气中引起污染。
(1)装置A用于制取氯气,其中使用恒压漏斗的原因是防止因反应过于剧烈而使液体无法滴落;
(2)为防止装置C中K2FeO4分解,可以采取的措施是将装置C置于冰水浴中和KOH应过量(或减缓通入氯气的速率等);
(3)装置C中利用氯气在碱性条件下将氢氧化铁氧化生成K2FeO4,反应的离子方程式为3Cl2+2Fe(OH)3+10OH-=2FeO42-+6Cl-+8H2O;
(4)用一定量的K2FeO4处理饮用水,K2FeO4与水发生反应生成的Fe(OH)3具有催化作用,t1 s~t2 s内,O2的体积迅速增大;
(5)验证酸性条件下氧化性FeO42->Cl2的实验方案为:取少量K2FeO4固体于试管中,向其中滴加少量浓盐酸,将湿润的淀粉KI试纸靠近试管口,若试纸变蓝,则说明有Cl2生成,同时说明氧化性FeO42->Cl2;
(6)根据K2FeO4的制备实验得出:氧化性Cl2>FeO42-,而第(5)小题实验表明,溶液的酸碱性影响物质的氧化性强弱,在不同的酸碱性环境中,Cl2和FeO42-的氧化性强弱关系相反。


科目:高中化学 来源: 题型:
【题目】用下图装置加以必要的导线连接后达到粗铜精炼的目的。
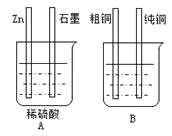
⑴A烧杯是________________(填〝电解池〞或〝原电池〞),
B烧杯是________________(填〝电解池〞或〝原电池〞)。
⑵其中Zn接B烧杯中的___________,(填“粗铜”或“纯铜”),B烧杯中应该盛____________溶液。
⑶分别写出石墨棒和纯铜棒的电极反应式
石墨棒:____________________________________,
纯铜棒:____________________________________。
⑷若锌减少了0.65 g,则纯Cu的质量增加了________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石经处理后得到明矾(KAl(SO4)2·12H2O)。由明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
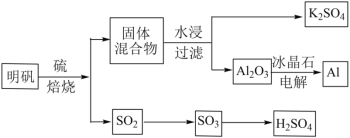
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂和还原剂的物质的量之比为_______。
(2)从水浸后的滤液中得到K2SO4晶体的操作方法是_______。
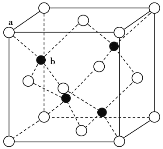
(3)A12O3在一定条件下可制得AIN,AlN的晶体结构与金刚石相似,晶胞结构如图所示。每个晶胞中含有_______个铝原子,若Al与N原子最近距离为apm,则该晶体的密度为_______g/cm3。(阿伏加德罗常数用NA表示)
(4)SO2分子的空间构型为_______
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101kPa时
2SO2(g)+O2(g)![]() 2SO3(g)△H1=一197kJ/mol;
2SO3(g)△H1=一197kJ/mol;
2H2O(g)=2H2O(1)△H2=一44kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知该反应4NH3+5O2=4NO+6H2O中,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是
A.![]() v(NH3)=v(O2)B.
v(NH3)=v(O2)B.![]() v(O2)=v(H2O)
v(O2)=v(H2O)
C.![]() v(NH3)=v(H2O)D.
v(NH3)=v(H2O)D.![]() v(O2)=v(NO)
v(O2)=v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学学习小组利用如图装置来制取乙酸乙酯。
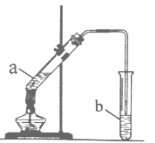
I.实验过程:向试管a中加入碎瓷片,3mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸,最后加入2mL乙酸,按图连接好装置,用酒精灯缓慢加热,将产生的蒸汽经导管通到b试管中的液面上。
II. 已知化学方程式:CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
III.查阅资料得知:乙酸乙酯不溶于水,密度比水小,且有香味
请回答下列问题:
(1)试管a中加入碎瓷片,其作用是_____(填字母代号)。
A.加快化学反应速率 B.防止溶液暴沸
(2)试管b中的溶液是_____(填字母代号)。
A饱和碳酸钠溶液 B.饱和氢氧化钠溶液
(3)实验完毕后,将b试管中的液体充分振荡,静置后,溶液分为两层。
①乙酸乙酯在________(填“上层”或“下层”)。
②常用________操作将两层液体分离(填“过滤”或“分液”)。
(4)实验中加入乙酸的质量为2.1g,其中60%的乙酸发生酯化反应,则得到乙酸乙酯的质量为______g(计算结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛能够发生下列反应:
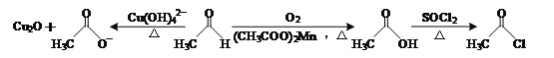
(1)Mn2+的基态电子排布式为____。
(2)氯化亚砜(SOCl2)是有机合成中重要的氯化剂,与SOCl2互为等电子体的阴离子的化学式为____。
(3)CH3CHO分子中碳原子的轨道杂化类型是____。
(4)乙酸的沸点(117.9 ℃)比乙醛的沸点(20.8 ℃)高的主要原因是____。
(5)不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为____。
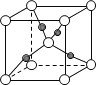
(6)如图表示Cu2O的晶胞,Cu+的配位数是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中,错误的是( )
A.NH4H是一种离子晶体,其中氢离子的核外电子排布与氦原子相同
B.在石墨晶体中,碳原子与共价键的个数比为2:3
C.三种氢化物的沸点高低:HBr>HCl>HF
D.甲基的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为:N2H4+O2=N2+H2O,下列关于该电池工作时的说法正确的是( )

A. 该装置工作时,Ag电极上有气体生成
B. 甲池中负极反应为N2H4-4e-=N2+4H+
C. 甲池和乙池中的溶液的pH均减小
D. 当甲池中消耗0.1molN2H4时,乙池中理论上最多产生6.4g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向pH=6的蒸馏水中加入NaHSO4固体,保持温度不变,测得溶液pH为1。对于该溶液,下列叙述不正确的是
A. 该温度高于25℃
B. 由水电离出来的c(H+)=1×10-13mol/L
C. c(H+)+c(Na+)=c(OH-)+2c(SO42-)
D. 该温度下加入等体积pH为11的KOH溶液,可使反应后的溶液恰好呈中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com