
【题目】某校化学学习小组利用如图装置来制取乙酸乙酯。
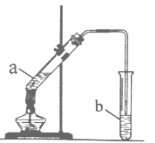
I.实验过程:向试管a中加入碎瓷片,3mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸,最后加入2mL乙酸,按图连接好装置,用酒精灯缓慢加热,将产生的蒸汽经导管通到b试管中的液面上。
II. 已知化学方程式:CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
III.查阅资料得知:乙酸乙酯不溶于水,密度比水小,且有香味
请回答下列问题:
(1)试管a中加入碎瓷片,其作用是_____(填字母代号)。
A.加快化学反应速率 B.防止溶液暴沸
(2)试管b中的溶液是_____(填字母代号)。
A饱和碳酸钠溶液 B.饱和氢氧化钠溶液
(3)实验完毕后,将b试管中的液体充分振荡,静置后,溶液分为两层。
①乙酸乙酯在________(填“上层”或“下层”)。
②常用________操作将两层液体分离(填“过滤”或“分液”)。
(4)实验中加入乙酸的质量为2.1g,其中60%的乙酸发生酯化反应,则得到乙酸乙酯的质量为______g(计算结果保留两位小数)。
【答案】B A 上层 分液 1.85
【解析】
根据实验室制备乙酸乙酯的实验原理及装置分析解答;根据关系式计算产物的质量。
(1)液体乙酸乙醇沸点低,加热要加碎瓷片,防止暴沸,故答案为:B;
(2)试管b中的溶液是饱和Na2CO3溶液,用于中和乙酸,溶解乙醇,降低乙酸乙酯在水中的溶解度,故答案为:A;
(3)实验完毕后,将b试管中的液体充分振荡,静置后,溶液分为两层,乙酸乙酯密度比水小,在上层,常用分液操作将两层液体分离,故答案为:上层;分液;
(4)设得到的乙酸乙酯的物质的量为x,
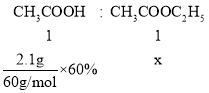
x=0.021mol,m(CH3COOC2H5)=0.021mol×88g/mol≈1.85g,即得到乙酸乙酯的质量为1.85g,故答案为:1.85。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在T℃条件下,向lL固定体积的密闭容器M中加入2molX和lmolY,发生如下反应:2X(g)+Y(g)![]() aZ(g)+W(g) ΔH=-QkJ·mol-1(Q>0)。当反应达到平衡后,放出的热量为Q1kJ。若平衡后再升高温度,混合气体的平均相对分子质量减小。维持温度T℃不变,若起始时向容器M中加入物质的物质的量如下,则反应达到平衡后放出的热量仍为Q1kJ的是( )
aZ(g)+W(g) ΔH=-QkJ·mol-1(Q>0)。当反应达到平衡后,放出的热量为Q1kJ。若平衡后再升高温度,混合气体的平均相对分子质量减小。维持温度T℃不变,若起始时向容器M中加入物质的物质的量如下,则反应达到平衡后放出的热量仍为Q1kJ的是( )
A.2molX、1molY、1molAr
B.amolZ、1molW
C.1molX、0.5molY、0.5amolZ、0.5molW
D.2molX、1molY、1molZ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:
(1)混合气体的密度是_________。
(2)混合气体的平均摩尔质量是_________。
(3)CO2和CO的体积之比是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得结论正确的是
A.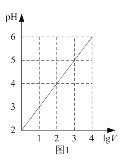 图1表示1 LpH=2的某一元酸加水稀释至V L,pH随lgV的变化,说明该酸是弱酸
图1表示1 LpH=2的某一元酸加水稀释至V L,pH随lgV的变化,说明该酸是弱酸
B.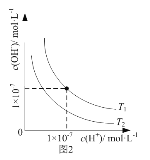 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,说明图中温度T2>T1
图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,说明图中温度T2>T1
C.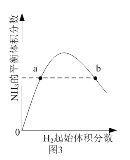 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,说明图中a点N2的转化率小于b点
图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,说明图中a点N2的转化率小于b点
D.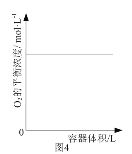 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s)
图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s)![]() 2BaO(s)+O2(g), O2的平衡浓度与容器容积的关系,说明改变压强平衡不发生移动
2BaO(s)+O2(g), O2的平衡浓度与容器容积的关系,说明改变压强平衡不发生移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图装置(夹持装置略)制备高效水处理剂高铁酸钾(K2FeO4)并探究其性质。
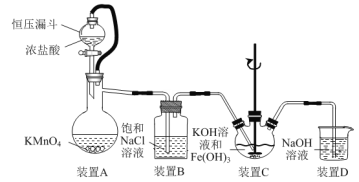
已知K2FeO4具有下列性质:①可溶于水,微溶于浓KOH溶液;②在0℃~5℃、强碱性溶液中比较稳定,在Fe(OH)3或Fe3+催化下发生分解;③在弱碱性至酸性条件下,能与水反应生成O2和Fe(OH)3(或Fe3+)。
(1)装置A用于制取氯气,其中使用恒压漏斗的原因是____。
(2)为防止装置C中K2FeO4分解,可以采取的措施是____和____。
(3)装置C中生成K2FeO4反应的离子方程式为____。
(4)用一定量的K2FeO4处理饮用水,测得产生O2的体积随时间的变化曲线如图所示。t1 s~t2 s内,O2的体积迅速增大的主要原因是____。
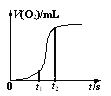
(5)验证酸性条件下氧化性FeO42->Cl2的实验方案为:取少量K2FeO4固体于试管中,____。(实验中须使用的的试剂和用品有:浓盐酸,NaOH溶液、淀粉KI试纸、棉花)
(6)根据K2FeO4的制备实验得出:氧化性Cl2>FeO42-,而第(5)小题实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷的分子结构可简写成键线式结构![]() ,有机物A的键线式结构为
,有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A. 用系统命名法命名有机物A,名称为2,2,3﹣三甲基戊烷
B. 有机物A的一氯取代物只有4种
C. 有机物A的分子式为C8H18
D. B的结构可能有3种,其中一种名称为3,4,4﹣三甲基﹣2﹣戊烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题。
(1)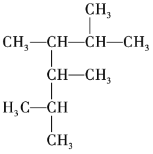 的名称为______。
的名称为______。
(2) 的名称为______。
的名称为______。
(3)3-甲基-2-戊烯的结构简式为______。
(4)1,3,5-三甲基苯的结构简式为______。
(5)某烷烃的相对分子质量为72,其一氯代物只有一种,该烷烃的结构简式为______。
(6)2,3-二甲基-2-丁烯的键线式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲硅烷广泛用于电子工业、汽车领域,三氯氢硅(![]() )是制备甲硅烷的重要原料。回答下列问题:
)是制备甲硅烷的重要原料。回答下列问题:
(1)工业上以硅粉和氯化氢气体为原料生产![]() 时伴随发生的反应有:
时伴随发生的反应有:
①![]()
②![]()
以硅粉和氯化氢气体生产![]() 的热化学方程式是_______________________。
的热化学方程式是_______________________。
(2)工业上可用四氯化硅和氢化铝锂(![]() )制甲硅烷,反应后得甲硅烷及两种盐。该反应的化学方程式为_________________________________________________。
)制甲硅烷,反应后得甲硅烷及两种盐。该反应的化学方程式为_________________________________________________。
(3)三氯氢硅歧化也可制得甲硅烷。反应![]() 为歧化制甲硅烷过程的关键步骤,此反应采用一定量的
为歧化制甲硅烷过程的关键步骤,此反应采用一定量的![]() 催化剂,在不同反应温度下测得
催化剂,在不同反应温度下测得![]() 的转化率随时间的变化关系如图所示。
的转化率随时间的变化关系如图所示。
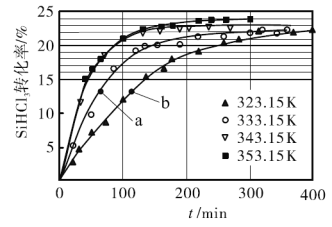
①![]() 时,平衡转化率为_________。该反应是__________反应(填“放热”或“吸热”)。
时,平衡转化率为_________。该反应是__________反应(填“放热”或“吸热”)。
②![]() 时,要缩短反应达到平衡的时间,可采取的措施有________________________。(答一种即可)
时,要缩短反应达到平衡的时间,可采取的措施有________________________。(答一种即可)
③比较a、b处反应速率的大小:![]() _______________
_______________![]() (填“>”“<”或“=”)。已知反应速率
(填“>”“<”或“=”)。已知反应速率![]() 分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,则在
分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,则在![]() 时
时![]() ___________(保留3位小数)。
___________(保留3位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com