
【题目】标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:
(1)混合气体的密度是_________。
(2)混合气体的平均摩尔质量是_________。
(3)CO2和CO的体积之比是__________。
【答案】1.339 g/L 30 g/mol 1:7
【解析】
(1)根据ρ=![]() 计算;
计算;
(2)根据M=![]() 计算;
计算;
(3)假设混合气体中CO、CO2的物质的量分别是x、y,根据二者质量和为15 g,物质的量的和为n=11.2 L÷22.4 L/mol=0.5 mol计算,然后利用气体的体积比等于物质的量的比计算。
(1)混合气体质量是15 g,体积为11.2 L,则该条件下混合气体的密度是ρ=![]() =1.339 g/L;
=1.339 g/L;
(2)在标准状况下11.2 L气体的物质的量n=11.2 L÷22.4L/mol=0.5 mol,气体的质量是15 g,所以该混合气体的摩尔质量M=![]() =30 g/mol;
=30 g/mol;
(3)假设在标准状况下混合气体中CO、CO2的物质的量分别是x、y,则x+y=0.5,28x+44y=15,解得x=0.4375 mol,y=0.0625 mol,根据阿伏加德罗定律可知:在相同条件下气体的体积比等于气体的物质的量的比,所以CO2和CO的体积之比V(CO2):V(CO)=y:x=0.0625 mol:0.4375 mol=1:7。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】甲装置中所含的是物质的量之比为1:2的CuSO4和NaCl的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应)。试分析下列叙述中正确的是( )
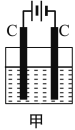
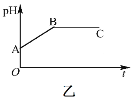
A.是该混合溶液中的SO42-导致了A点溶液的pH值小于B点
B.AB线段与BC线段在阴极上发生的反应是相同的,即:Cu2+ + 2e=Cu
C.BC段阴极产物和阳极产物的体积之比为2:1
D.在整个电解的过程中会出现少量淡蓝色的Cu(OH)2沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解精炼铜的阳极泥中主要含Ag、Au等贵重金属,还含有少量 CeF4。以下是从精炼铜的阳极泥中回收银、金的流程图:
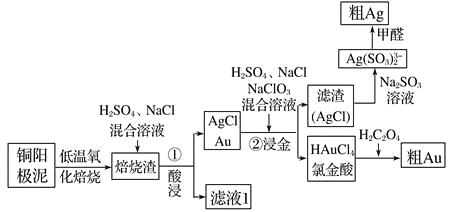
已知:①Ce 常见的化合价为+3、+4 价;②CeF4 很稳定,1000℃ 时仍不分解。
(1)①酸浸步骤中有少量黄绿色气体生成,滤液 1 中含有CeCl3,写出焙烧渣酸浸生成 CeCl3的化学方程式_________________________________________ 。
(2)铜阳极泥氧化时,采用“低温焙烧”而不采用“高温焙烧”的原因是__________
(3)“②浸金”反应中, H2SO4 的作用为_________________________,该步骤的分离操作中, 需要对所得的 AgCl 进行水洗。判断 AgCl 已经洗涤干净的方法是:取最后一次洗涤液,滴________________________试剂,出现_______现象,证明 AgCl 未洗涤干净。
(4)氯金酸(HAuCl4)在 pH 为 2~3 的条件下被草酸还原为 Au,同时放出二氧化碳气体,写出该反应方程式_____________________________________________
(5)甲醛还原法沉积银,(Ag(SO3 )2 3-)通常是在搅拌下于室温及弱碱性条件下进行,甲醛被氧化为碳酸氢根离子,则该反应的离子方程式为 _______________
(6)电解法精炼银,用 10A 的电流电解 30min,若电解效率(通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比)为 80%,此时可得到银单质的质量为__________ (保留 1 位小数,法拉第常数 96500C/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡金属元素在日常生活中有广泛的应用。
(1)金属钒在材料科学上有重要作用,被称为“合金的维生素”,基态钒原子的价层电子的排布式为 __________;基态 Mn原子核外有____种运动状态不同的电子,M层的电子云有_______种不同的伸展方向。
(2)第四周期元素的第一电离能随原子序数增大,总趋势是逐渐增大的,但Ga的第一电离能明显低于Zn,原因是 ____________________________________
(3)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验 K+的存在。与NO2-互为等电子体的微粒__________(写出一种),K3[Co(NO2)6]中存在的作用力有___________a.σ键 b.π键 c.配位键 d.离子键 e.范德华力
(4)锰的一种配合物的化学式为 Mn(BH4)2(THF)3,BH4-的空间构型为____________
(5)FeO 是离子晶体,其晶格能可通过下图中的 Born—Haber 循环计算得到。
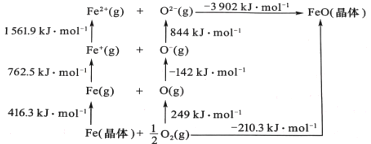
可知,O原子的第一电子亲和能为 ________kJmol-1,FeO晶格能为________kJmol-1。
(6)铜与氧可形成如图所示的晶胞结构,其中 Cu 均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则 d 点的坐标参数为_______________,已知该晶体的密度为ρgcm-3,NA是阿伏伽德罗常数的值,则晶胞参数为_________pm
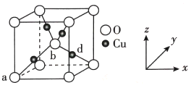
(列出计算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬鞣剂[Cr(OH)SO4]可用于提高皮革的耐曲折强度。一种以铬渣(含Cr2O3及少量Fe2O3、CaO、Al2O3、SiO2等杂质)为原料制备Cr(OH)SO4的工艺流程如图:
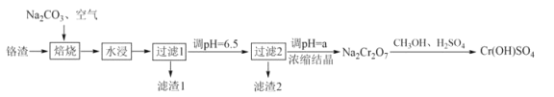
回答下列问题:
(1)“焙烧”时,Cr2O3转化为Na2CrO4的化学方程式为__。
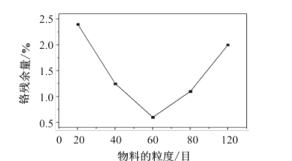
(2)“水浸”过程中,物料的粒度(颗粒大小)对铬残余量的影响如图所示,则最佳反应条件为__。
(3)“滤渣1”中有一种成分为铁铝酸四钙(Ca4Fe2Al2O10),是制造水泥的原料之一,用氧化物的形式表示其化学式__。
(4)“滤渣2”主要成分为Al(OH)3和__(填化学式),“过滤2”后,将溶液pH调至a,a__6.5(填“小于”或“大于”),目的是__(用离子方程式表示)。
(5)已知CH3OH在酸性条件下可被氧化生成CO2,写出Na2Cr2O7与CH3OH反应生成Cr(OH)SO4的化学方程式__。
(6)某厂用m1kg的铬渣(含Cr2O340%)制备Cr(OH)SO4,最终得到产品m2kg,则产率为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是炼铜的主要矿物,在野外很容易被误会为黄金,因此被称为愚人金。回答下列问题:
(1)处于激发态的S原子,其中1个3s电子跃迁到3p轨道上,该激发态S原子的核外电子排布式为__。同族元素的氢化物中,H2O比H2Te沸点高的原因是__。
(2)检验Fe2+的试剂有多种,其中之一是铁氰化钾(K3[Fe(CN)6]),又称赤血盐。
①在配合物K3[Fe(CN)6]中,易提供孤电子对的成键原子是__(填元素名称),含有12molσ键的K3[Fe(CN)6]的物质的量为__mol。
②赤血盐中C原子的杂化方式为__;C、N、O三种元素第一电离能由大到小的排序为___;写出与CN-互为等电子体的一种化合物的化学式__。
③Fe、Na、K的晶胞结构相同,但钠的熔点比钾更高,原因是___。
(3)CuFeS2的晶胞结构如图所示。已知:晶胞参数a=0.524nm,c=1.032nm。则CuFeS2的晶胞中每个Cu原子与__个S原子相连,晶体密度ρ=__g·cm-3(列出计算表达式)。
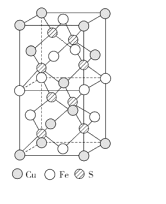
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,由图中数据分析,反应物是____,t2时,N的浓度是_______________;若t2=1 min,从反应开始到t2 ,M的平均反应速率为_____________; 该反应的化学方程式为______;在反应达到化学平衡时,各组分的浓度保持______(填“相等”或“不变”)且_______(填“一定”或“不一定”相等,各物质的反应速率之比_______(填“一定”或“不一定”)等于化学计量数之比。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组用如装置比较氯、溴、碘的非金属性强弱实验(夹持仪器已略去,气密性已检验)。
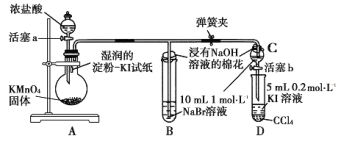
实验步骤:
①打开弹簧夹,打开活塞a,滴加浓盐酸;
②当B和C中的溶液都变为黄色时,夹紧弹簧夹;
③当B中溶液由黄色变为棕红色时,关闭活塞a;
④打开活塞b,将少量C中溶液滴入试管D中,关闭活塞b,取下试管D振荡,静置后CCl4层变为紫红色。请回答:
(1)装置A中证明氯的非金属性强于碘的实验现象是_______________________。
(2)B中溶液发生反应的离子方程式是____________________________________。
(3)步骤③实验的目的是确认C的黄色溶液中无_____(填化学式)。步骤④能否说明非金属性:Br>I_______(填“能”或“否”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定碳酸氢钠纯度(含有少量氯化钠),某学生拟用如图实验装置,以下实验设计正确的是
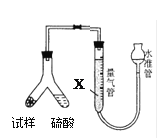
A.可用稀盐酸代替稀硫酸
B.量气管中液体为水
C.反应完全后,冷却,读取量气管体积数,再减去所加硫酸的体积,即为生成的气体体积
D.实验测得该试样中碳酸氢钠质量分数偏高,可能是测定气体体积时未冷却至室温
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com