
【题目】电解精炼铜的阳极泥中主要含Ag、Au等贵重金属,还含有少量 CeF4。以下是从精炼铜的阳极泥中回收银、金的流程图:
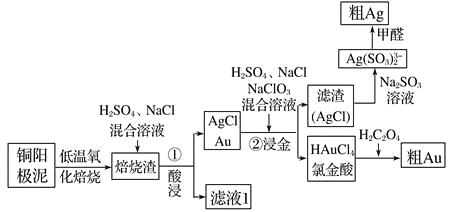
已知:①Ce 常见的化合价为+3、+4 价;②CeF4 很稳定,1000℃ 时仍不分解。
(1)①酸浸步骤中有少量黄绿色气体生成,滤液 1 中含有CeCl3,写出焙烧渣酸浸生成 CeCl3的化学方程式_________________________________________ 。
(2)铜阳极泥氧化时,采用“低温焙烧”而不采用“高温焙烧”的原因是__________
(3)“②浸金”反应中, H2SO4 的作用为_________________________,该步骤的分离操作中, 需要对所得的 AgCl 进行水洗。判断 AgCl 已经洗涤干净的方法是:取最后一次洗涤液,滴________________________试剂,出现_______现象,证明 AgCl 未洗涤干净。
(4)氯金酸(HAuCl4)在 pH 为 2~3 的条件下被草酸还原为 Au,同时放出二氧化碳气体,写出该反应方程式_____________________________________________
(5)甲醛还原法沉积银,(Ag(SO3 )2 3-)通常是在搅拌下于室温及弱碱性条件下进行,甲醛被氧化为碳酸氢根离子,则该反应的离子方程式为 _______________
(6)电解法精炼银,用 10A 的电流电解 30min,若电解效率(通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比)为 80%,此时可得到银单质的质量为__________ (保留 1 位小数,法拉第常数 96500C/mol)。
【答案】2CeF4 + 4H2SO4 + 8NaCl = 2CeCl3+ 4Na2SO4 + 8HF + Cl2↑ 高温焙烧时,生成的Ag2O又分解为Ag和O2 提供H+,增强NaClO3的氧化性 Ba(NO3)2溶液 有白色沉淀产生 2HAuCl4+3H2C2O4 = 2Au+8HCl+6CO2↑ 4Ag(SO3)23 + HCHO + 5OH-=4Ag + 8SO32 + 3H2O + HCO3- 16.1g
【解析】
⑴①酸浸步骤中有少量黄绿色气体生成,滤液1中含有CeCl3,说明CeF4与H2SO4、NaCl反应生成CeCl3、Cl2等,根据氧化还原反应书写化学方程式;
⑵高温时,氧化银分解又生成Ag和氧气;
⑶“②浸金”反应中,加硫酸能提供H+,增强NaClO3的氧化性;溶液中含有硫酸根离子,加Ba(NO3)2溶液来检验最后一次洗液中是否含有硫酸根离子;
⑷氯金酸与草酸反应生成Au、HCl和二氧化碳,根据氧化还原反应书写化学方程式;
⑸甲醛还原法沉积银,(Ag(SO3 )23)通常是在搅拌下于室温及弱碱性条件下进行,甲醛被氧化为碳酸氢根离子,根据氧化还原反应书写离子方程式;
⑹先计算电路中电子物质的量,再计算生成的银质量。
⑴①酸浸步骤中有少量黄绿色气体生成,滤液1中含有CeCl3,说明CeF4与H2SO4、NaCl反应生成CeCl3等,根据氧化还原反应得到化学方程式2CeF4 + 4H2SO4 + 8NaCl = 2CeCl3+ 4Na2SO4 + 8HF + Cl2↑,故答案为:2CeF4 + 4H2SO4 + 8NaCl = 2CeCl3+ 4Na2SO4 + 8HF + Cl2↑;
⑵低温焙烧时,Ag与氧气转化为Ag2O,高温时,氧化银分解又生成Ag和氧气,因此采用“低温焙烧”而不采用“高温焙烧”,故答案为:高温焙烧时,生成的Ag2O又分解为Ag和O2;
⑶“②浸金”反应中,酸性条件下,Au与氯酸钠反应,加硫酸能提供H+,增强NaClO3的氧化性;溶液中含有硫酸根离子,检验最后一次洗液中是否含有硫酸根离子,其操作为取最后一次洗涤液少许于试管中,滴入Ba(NO3)2溶液,若没有白色沉淀产生,则已经洗涤干净,反之,则需要继续洗涤,故答案为:提供H+,增强NaClO3的氧化性;Ba(NO3)2溶液;有白色沉淀产生;
⑷氯金酸与草酸反应生成Au、HCl和二氧化碳,反应的化学方程式为:2HAuCl4+3H2C2O4 = 2Au+8HCl+6CO2↑,故答案为:2HAuCl4+3H2C2O4 = 2Au+8HCl+6CO2↑;
⑸甲醛还原法沉积银,(Ag(SO3 )23)通常是在搅拌下于室温及弱碱性条件下进行,甲醛被氧化为碳酸氢根离子,则该反应的离子方程式为4Ag(SO3)23 + HCHO + 5OH-=4Ag + 8SO32 + 3H2O + HCO3-,故答案为:4Ag(SO3)23 + HCHO + 5OH-=4Ag + 8SO32 + 3H2O + HCO3-;
⑹电解法精炼银,用 10A 的电流电解 30min,电路中电子物质的量为![]() ,若电解效率为 80%,生成1mol银转移1mol电子,所以生成的银为0.1865mol×80%×108 gmol1 ≈16.1g,故答案为:16.1g。
,若电解效率为 80%,生成1mol银转移1mol电子,所以生成的银为0.1865mol×80%×108 gmol1 ≈16.1g,故答案为:16.1g。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】“麻黄素”是中枢神经兴奋剂,其合成路线如图所示:
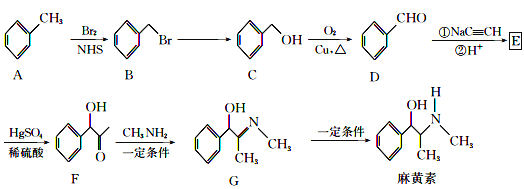
已知:CH3C![]() CH+H2O
CH+H2O![]()
(1)F中的官能团的名称为__。
(2)B→C的反应条件是__,反应类型是__,E的结构简式为__。
(3)写出C→D的化学反应方程式__。
(4)麻黄素的分子式为__。
(5)H是G的同系物,也含醇羟基和碳氮双键,相对分子质量比G小28,且苯环上仅有一个侧链,则H的可能结构有___种(不考虑![]() 结构)。
结构)。
(6)已知:R-C![]() C-R
C-R![]() R-CH=CH-R,请仿照题中流程图合成路线,设计以乙醇为起始主原料合成强吸水性树脂
R-CH=CH-R,请仿照题中流程图合成路线,设计以乙醇为起始主原料合成强吸水性树脂![]() 的合成路线,其它试剂及溶剂任选__。
的合成路线,其它试剂及溶剂任选__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是中学化学中常见的气体,其用途广泛。
(1)工业上氨气可以由氢气和氮气合成。
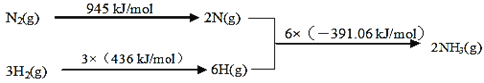
①该反应的热化学方程式是___。
②450℃,将5molN2和5molH2充入2L恒容密闭容器中发生反应,5min后达到平衡,N2的转化率为20%,则NH3的化学反应速率v(NH3)=___,该温度下如图所示反应的平衡常数的数值K=___,温度升高,平衡常数K将___(填“增大”、“减小”或“不变”)。
(2)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。
①当氨水中所含氨的物质的量为3mol,吸收标准状况下44.8LSO2时,溶液中的溶质为___。
②已知NH4HSO3溶液显酸性。用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确的是___。
A.c(NH4+)=2c(SO32-)+c(HSO3-)
B.c(NH4+)>c(SO32-)>c(H+)=c(OH-)
C.c(NH4+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
D.c(NH4+)+c(NH3·H2O)=c(SO32-)+c(HSO3-)+c(H2SO3)
(3)氨气是一种富氢燃料,可以直接用于燃料电池,如图是供氨水式燃料电池工作原理:
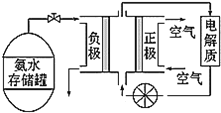
①氨气燃料电池的电解质溶液最好选择___(填“酸性”、“碱性”或“中性”)溶液。
②氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池的总反应方程式为___,正极的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g) ΔH1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g) ΔH2
③Sn(s、灰)![]() Sn(s、白) ΔH3=+2.1kJ/mol,下列说法不正确的是( )
Sn(s、白) ΔH3=+2.1kJ/mol,下列说法不正确的是( )
A.灰锡与白锡互为同素异形体
B.锡在常温下以白锡状态存在
C.白锡转化为灰锡的反应是放热反应
D.ΔH1﹥ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.增大压强使平衡向生成Z的方向移动,平衡常数增大
B.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.反应达到平衡时,X的转化率为50%
D.增大X的浓度,Y的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分子式为C4H8O2的有机物的同分异构体的说法中,不正确的是
A.能与NaOH溶液反应的同分异构体共有6种
B.存在分子中含有六元环的同分异构体
C.既含有羟基又含有醛基的有5种
D.不存在含有2个羟基的同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A(C4H10O)是一种有机溶剂,且A只有一种一氯取代物B,在一定条件下A可以发生如下变化:
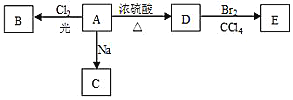
(1)A分子中的官能团名称是___,A的结构简式是___;
(2)写出下列化学方程式:
A→B:___;A→D:___;
(3)A的同分异构体F也可以有框图内A的各种变化,且F的一氯取代物有三种。F的结构简式是:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:
(1)混合气体的密度是_________。
(2)混合气体的平均摩尔质量是_________。
(3)CO2和CO的体积之比是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界水产养殖协会网介绍了一种利用电化学原理净化鱼池中水质的方法,其装置如图所示。下列说法正确的是

A. X为电源负极
B. 若该装置在高温下进行,则净化效率将降低
C. 若有1molNO3-被还原,则有6molH+通过质子膜迁移至阴极区
D. 若BOD为葡萄糖(C6H12O6),则1mol葡萄糖被完全氧化时,理论上电极流出20 mol e-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com