
����Ŀ����������ѧ��ѧ�г��������壬����;�㷺��
��1����ҵ�ϰ��������������͵����ϳɡ�
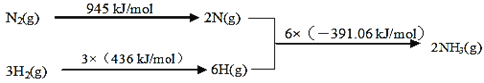
�ٸ÷�Ӧ���Ȼ�ѧ����ʽ��___��
��450�棬��5molN2��5molH2����2L�����ܱ������з�����Ӧ��5min��ﵽƽ�⣬N2��ת����Ϊ20%����NH3�Ļ�ѧ��Ӧ����v(NH3)=___�����¶�����ͼ��ʾ��Ӧ��ƽ�ⳣ������ֵK=___���¶����ߣ�ƽ�ⳣ��K��___������������������С����������������
��2����ҵ�������β���к��϶��SO2��Ϊ��ֹ��Ⱦ��������������SO2����ҵ�ϳ��ð�ˮ���շ�����β����
�ٵ���ˮ�������������ʵ���Ϊ3mol�����ձ�״����44.8LSO2ʱ����Һ�е�����Ϊ___��
����֪NH4HSO3��Һ�����ԡ��ð�ˮ����SO2��������Һ������ʱ����Һ������Ũ�ȹ�ϵ��ȷ����___��
A.c(NH4+)=2c(SO32-)+c(HSO3-)
B.c(NH4+)>c(SO32-)>c(H+)=c(OH-)
C.c(NH4+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
D.c(NH4+)+c(NH3��H2O)=c(SO32-)+c(HSO3-)+c(H2SO3)
��3��������һ�ָ���ȼ�ϣ�����ֱ������ȼ�ϵ�أ���ͼ�ǹ���ˮʽȼ�ϵ�ع���ԭ����
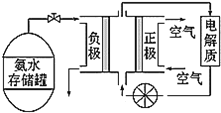
�ٰ���ȼ�ϵ�صĵ������Һ���ѡ��___������������������������������������Һ��
�ڰ���ȼ�ϵ�صķ�Ӧ�ǰ�������������һ�ֳ������������ˮ���õ�ص��ܷ�Ӧ����ʽΪ___�������ĵ缫��ӦʽΪ___��
���𰸡�N2(g)+3H2(g)=2NH3(g) ��H=-93.36kJ/mol 0.2mol��L-1��min-1 0.5 ��С (NH4)2SO3��NH4HSO3 AB ���� 4NH3+3O2=2N2+6H2O O2+4e-+2H2O=4OH-����3O2+12e-+6H2O=12OH-��
��������
(1)���ȸ�����H=��Ӧ����ܺ�-��������ܺ������H������д�Ȼ�ѧ����ʽ���ڽ�ϻ�ѧƽ������ʽ��ʽ���㣻
(2)�ٰ������ʵ���Ϊ3mol����״����44.8L SO2�����ʵ���Ϊ2mol���������պ���Һ��Nԭ�Ӻ�Sԭ�ӵĹ�ϵ���(NH4)2SO3��NH4HSO3�Ļ�ѧʽ�����жϣ������õ���غ㡢�����غ����Һ������Է����жϣ�
(3)�ٰ����Ǽ������壻�����ɵ�������ʱN2���ݴ���д�ܷ�Ӧ������������������ԭ��Ӧ����ϼ��Ի�����д������Ӧʽ��
(1)�١�H=��Ӧ�����֮��-���������֮��=945kJ/mol+3��436kJ/mol-6��391.06kJ/mol =-93.36 kJ/mol�����ԣ����Ȼ�ѧ����ʽΪ��N2(g)+3H2(g)2NH3(g) ��H=-93.36 kJ/mol���ʴ�Ϊ��N2(g)+3H2(g)2NH3(g)��H=-93.36 kJ/mol��
��450�棬2L�ܱ������У�5mol N2��5mol H2������Ӧ���ﵽƽ��ʱ��N2��ת����Ϊ20%.

NH3�Ļ�ѧ��Ӧ����v(NH3)=![]() = 0.2mol��L-1��min-1��ƽ�ⳣ��K=
= 0.2mol��L-1��min-1��ƽ�ⳣ��K=![]() =0.5�����¶��·�Ӧ��ƽ�ⳣ������ֵ��0.5���÷�ӦΪ���ȷ�Ӧ���¶����ߣ�ƽ�������ƶ���ƽ�ⳣ��K����С���ʴ�Ϊ��0.2mol��L-1��min-1��0.5����С��
=0.5�����¶��·�Ӧ��ƽ�ⳣ������ֵ��0.5���÷�ӦΪ���ȷ�Ӧ���¶����ߣ�ƽ�������ƶ���ƽ�ⳣ��K����С���ʴ�Ϊ��0.2mol��L-1��min-1��0.5����С��
(2)�ٰ������ʵ���Ϊ3mol�����ձ�״����44.8L(2mol) SO2ʱ����Һ�к���Nԭ��3mol��Sԭ��2mol������ԭ���غ㣬��(NH4)2SO3�У���ԭ�Ӹ�����Ϊ2��1����NH4HSO3�У���ԭ�Ӹ�����Ϊ1��1�����ԣ���������(NH4)2SO3��NH4HSO3���ʴ�Ϊ��(NH4)2SO3��NH4HSO3��
��NH4HSO3��Һ�����ԣ��ð�ˮ����SO2��������Һ������ʱ��c(H+)=c(OH-)�����ݵ���غ㣺c(NH4+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)����c(NH4+)=2c(SO32-)+c(HSO3-)����A��ȷ��C������c(NH4+)>c(SO32-)>c(H+)=c(OH-)����B��ȷ��NH4HSO3��Һ�����ԣ�������Һ�����ԣ�˵����NH4HSO3�Ͱ�ˮ�Ļ����Һ�����������غ㣬c(NH4+)+c(NH3��H2O)��c(SO32-)+c(HSO3-)+c(H2SO3)����D���ʴ�Ϊ��AB��
(3)�ٰ����Ǽ������壬���Ե��Һ���ѡ�������Һ���ʴ�Ϊ�����ԣ�
�����ɵ���������N2����ѧ����ʽΪ��4NH3+3O2=2N2+6H2O������������������ԭ��Ӧ�������ĵ缫��ӦʽΪ��O2+4e-+2H2O=4OH-���ʴ�Ϊ��4NH3+3O2=2N2+6H2O��O2+4e-+2H2O=4OH-��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС����Ũ��Ϊ0.20 mol��L��1�������Һ�ζ�����һ�������ʵ��ռ���Ʒ(���������Ӧ)����ˮ�γɵ���Һ��
(1)ȷ��ȡһ������Ĵ���Һ��Ҫʹ�õ�������________________��
(2)���ζ���ʼ�ͽ���ʱ���ζ����е�Һ����ͼ��ʾ�������������Һ�����Ϊ______mL��
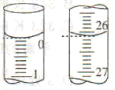
(3)�������Һ�ζ������ռ���Ʒ����Һʱ��________(������������������������ͬ)����ʽ�ζ��ܵĻ�����________ҡ����ƿ���۾�ʼ��ע��________________��
(4)�ζ�ʱ�����Է�̪Ϊָʾ�����ζ��ﵽ�յ�ı�־��__________��
(5)��ȷ��ȡ��5.0g�ռ���Ʒ���Ƴ�250mL����Һ�����������Һ�ζ����ζ�ǰ�������ζ�����������ʾ��
�ζ����� | ����Һ���(mL) | 0.20mol/L���������(mL) | |
�ζ�ǰ���� | �ζ������ | ||
��һ�� | 10.00 | 0.70 | 20.60 |
�ڶ��� | 10.00 | 4.00 | 24.10 |
������ | 10.00 | 1.10 | 21.10 |
��ʵ�����ݿ�֪���ռ�Ĵ���Ϊ________��
(6)���в����ᵼ�²�õĴ���Һ��Ũ��ƫ�����________(����)��
a�����ֱ�Һ�γ���ƿ��
b���ô�����Һ��ϴ��ƿ
c����ƿϴ������������ˮ
d���ų���Һ�ĵζ��ܿ�ʼ�����ݣ��ų�Һ���������ʧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
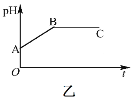
����Ŀ��25��C ʱ���� 10 mL 0.10 mol��L-1 �� HA ��Ka =1.0��10-4������μ��� 0.10 mol��L-1NaOH ��Һ����Һ pH ������ V[��NaOH��aq]�仯����ͼ��ʾ������˵����ȷ����
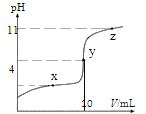
A.x �㣬c��HA��> c��A-��
B.y �㣬c��HA��+c��A-��=c��Na+�� =0.10 mol��L-1
C.z �㣬c��Na+�� = c��A-�� + c��OH-��
D.ˮ�ĵ���̶ȣ�x ��С�� y ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����װ���������������ʵ���֮��Ϊ1:2��CuSO4��NaCl�Ļ����Һ������������Һ��pHֵ��ʱ��t�仯��ʾ��ͼ����ʾ�������ǵ����������ˮ�ķ�Ӧ�����Է���������������ȷ���ǣ� ��
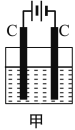
A.�Ǹû����Һ�е�SO42-������A����Һ��pHֵС��B��
B.AB�߶���BC�߶��������Ϸ����ķ�Ӧ����ͬ�ģ�����Cu2+ + 2e=Cu
C.BC�����������������������֮��Ϊ2:1
D.���������Ĺ����л������������ɫ��Cu(OH)2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
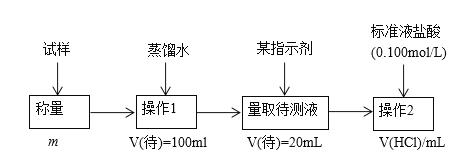
����Ŀ�����ⶨ�������Ȼ��Ƶ�С�մ��̬��Ʒ��NaHCO3�����������ɲ����������ַ�����
����һ��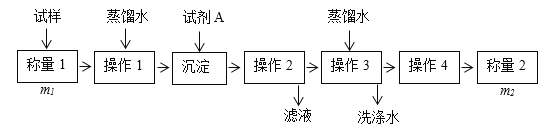
��������
��������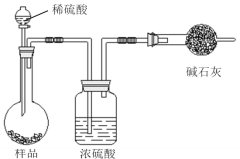
�����ģ���ʹ�û�ѧ�Լ���ʹ��ʵ���ҳ�������
��Ҫ��ش��������⣺
(1)����һ�������������Լ�A______����дA�Ļ�ѧʽ���ɽ�HCO3-����ת��Ϊ���������ء�����1��2��3��4�������������ܽ⡢_______��ϴ�Ӻ�_______��
(2)���������ڲ���1�����õ��IJ��������У������ձ����������⣬����Ҫ���õ�����_____���ڲ���2��Ӧѡ���ָʾ����____________��
(3)�ڷ������м������Ʒ��NaHCO3����������Ϊ___________[������ͼ�е�����m��V(HCl) ��д�йصı���ʽ]��
(4)�ڷ������У��������õ�ʵ��װ�ã����˳������������⣬����ⶨ��ʵ��������________��
(5)��ϸ�����������е�ʵ��װ�ã����ɴ˲�õ�����������ʵ���������п���ƫ��Ҳ�п���ƫ�ͣ�ƫ�ߵ�ԭ�������__________��ƫ�͵�ԭ�������_______�������ּ�������
(6)�����ĵ�ʵ��ԭ���ǣ�_____________���û�ѧ����ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ظ������һ����Ҫ�Ļ���ԭ�ϣ�һ���ɸ������Ʊ������������Ҫ�ɷ�ΪFeO��Cr2O3�������й衢�������ʡ��Ʊ�������ͼ��ʾ��
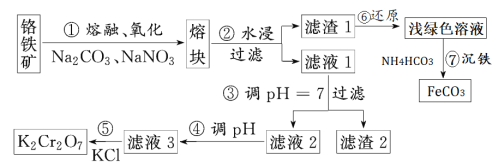
�ش��������⣺
��1������ٵ���Ҫ��ӦΪ��FeO��Cr2O3+Na2CO3+NaNO3��Na2CrO4+Fe2O3+CO2+NaNO2��������Ӧ��ƽ��NaNO3��FeO��Cr2O3���ϵ����Ϊ___���ò��費��ʹ���մ�������ԭ����___��
��2������1����Ҫ�ɷ���___������2�к������Ľ���Ԫ��������___��
��3������ܵ���Һ2��pH��С��Ŀ����___(�����ӷ���ʽ��ʾ)��
��4���й����ʵ��ܽ����ͼ��ʾ��������Һ3���м�������KCl��___��___�����˵õ�K2Cr2O7���塣�÷�Ӧ�ķ�Ӧ������___��
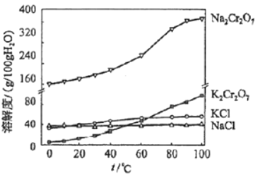
��5��д������7���漰�����ӷ���ʽ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����![]() ��
��![]() �Ͻ�����ˮ�У�����Ͻ���ȫ�ܽ⣬�õ�20mL��pH=14����Һ��Ȼ����1mol/L������ζ����������ʱ������40mL���ᡣԭ�Ͻ���
�Ͻ�����ˮ�У�����Ͻ���ȫ�ܽ⣬�õ�20mL��pH=14����Һ��Ȼ����1mol/L������ζ����������ʱ������40mL���ᡣԭ�Ͻ���![]() �����ʵ����� ��
�����ʵ����� ��
A.0.01molB.0.02molC.0.03molD.0.04mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����⾫��ͭ������������Ҫ��Ag��Au�ȹ��ؽ��������������� CeF4�������ǴӾ���ͭ���������л��������������ͼ��
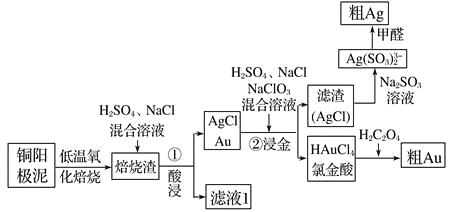
��֪����Ce �����Ļ��ϼ�Ϊ+3��+4 �ۣ���CeF4 ���ȶ���1000�� ʱ�Բ��ֽ⡣
��1�����������������������ɫ�������ɣ���Һ 1 �к���CeCl3��д��������������� CeCl3�Ļ�ѧ����ʽ_________________________________________ ��
��2��ͭ����������ʱ,���������±������������������±�������ԭ����__________
��3�����ڽ�������Ӧ��, H2SO4 ������Ϊ_________________________���ò���ķ��������, ��Ҫ�����õ� AgCl ����ˮϴ���ж� AgCl �Ѿ�ϴ�Ӹɾ��ķ����ǣ�ȡ���һ��ϴ��Һ����________________________�Լ�������_______����֤�� AgCl δϴ�Ӹɾ���
��4���Ƚ���(HAuCl4)�� pH Ϊ 2~3 �������±����ỹԭΪ Au��ͬʱ�ų�������̼���壬д���÷�Ӧ����ʽ_____________________________________________
��5����ȩ��ԭ��������,��Ag(SO3 )2 3-��ͨ�����ڽ����������¼������������½��У���ȩ������Ϊ̼���������,��÷�Ӧ�����ӷ���ʽΪ _______________
��6����ⷨ���������� 10A �ĵ������ 30min,�����Ч��(ͨ��һ������ʱ������ʵ�ʳ����Ľ���������ͨ����ͬ����ʱ������Ӧ�����Ľ�������֮��)Ϊ 80%,��ʱ�ɵõ������ʵ�����Ϊ__________ (���� 1 λС���������ڳ��� 96500C/mol)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���2L������ijһ��Ӧ��M��N�����ʵ����淴Ӧʱ��仯��������ͼ����ͼ�����ݷ�������Ӧ����____��t2ʱ��N��Ũ����_______________����t2=1 min���ӷ�Ӧ��ʼ��t2 ��M��ƽ����Ӧ����Ϊ_____________�� �÷�Ӧ�Ļ�ѧ����ʽΪ______���ڷ�Ӧ�ﵽ��ѧƽ��ʱ������ֵ�Ũ�ȱ���______(�����������������������_______(����һ����������һ������ȣ������ʵķ�Ӧ����֮��_______(����һ����������һ���������ڻ�ѧ������֮�ȡ�

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com