
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
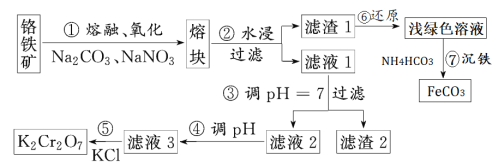
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3→Na2CrO4+Fe2O3+CO2+NaNO2。上述反应配平后NaNO3与FeO·Cr2O3与的系数比为___。该步骤不能使用陶瓷容器,原因是___。
(2)滤渣1中主要成分是___,滤渣2中含量最多的金属元素名称是___。
(3)步骤④调滤液2的pH变小的目的是___(用离子方程式表示)。
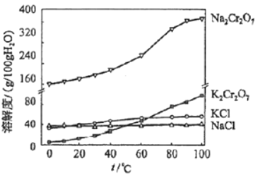
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,___、___,过滤得到K2Cr2O7固体。该反应的反应类型是___。
(5)写出步骤7中涉及的离子方程式___。
【答案】7:2 陶瓷在高温下会与Na2CO3反应 Fe2O3 铝 增大溶液中H+,促进平衡2CrO42-+2H+Cr2O72-+H2O正向移动 蒸发浓缩 冷却结晶 复分解反应 Fe2++2HCO3-=FeCO3↓+CO2↑+H2O
【解析】
铬铁矿的主要成分为FeOCr2O3,还含有硅、铝等杂质,制备重铬酸钾,由制备流程可知,步骤①的主要反应为FeO·Cr2O3+Na2CO3+NaNO3=Na2CrO4+Fe2O3+CO2+NaNO2,Cr元素的化合价由+3价升高为+6价,Fe元素的化合价由+2价升高为+3价,N元素的化合价由+5价降低为+3价,由电子、原子守恒可知,反应为2FeOCr2O3+4Na2CO3+7NaNO3![]() 4Na2CrO4+Fe2O3+4CO2+7NaNO2,该步骤中若使用陶瓷,二氧化硅与碳酸钠高温下反应生成硅酸钠和二氧化碳,则使用铁坩埚,熔块水浸过滤分离出滤渣1含Fe2O3,经还原可制备碳酸亚铁,滤液1中含NaAlO2、Na2CrO4、硅酸钠,调节pH=7,SiO32-离子转化为H2SiO3,AlO2-转化为Al(OH)3,过滤分离出Al(OH)3、H2SiO3,滤液2中含Na2CrO4,④中调节pH发生2CrO42-+2H+Cr2O72-+H2O,滤液3含Na2Cr2O7,由水中的溶解度:Na2Cr2O7>K2Cr2O7,可知⑤中向Na2Cr2O7溶液中加入KCl固体后得到K2Cr2O7,溶解度小的析出,以此解答该题。
4Na2CrO4+Fe2O3+4CO2+7NaNO2,该步骤中若使用陶瓷,二氧化硅与碳酸钠高温下反应生成硅酸钠和二氧化碳,则使用铁坩埚,熔块水浸过滤分离出滤渣1含Fe2O3,经还原可制备碳酸亚铁,滤液1中含NaAlO2、Na2CrO4、硅酸钠,调节pH=7,SiO32-离子转化为H2SiO3,AlO2-转化为Al(OH)3,过滤分离出Al(OH)3、H2SiO3,滤液2中含Na2CrO4,④中调节pH发生2CrO42-+2H+Cr2O72-+H2O,滤液3含Na2Cr2O7,由水中的溶解度:Na2Cr2O7>K2Cr2O7,可知⑤中向Na2Cr2O7溶液中加入KCl固体后得到K2Cr2O7,溶解度小的析出,以此解答该题。
(1)由上述分析可知步骤①的主要反应为2FeOCr2O3+4Na2CO3+7NaNO3![]() 4Na2CrO4+Fe2O3+4CO2+7NaNO2,则NaNO3与FeOCr2O3与的系数比为7:2;该步骤不能使用陶瓷容器,原因是二氧化硅与碳酸钠高温下反应生成硅酸钠和二氧化碳;
4Na2CrO4+Fe2O3+4CO2+7NaNO2,则NaNO3与FeOCr2O3与的系数比为7:2;该步骤不能使用陶瓷容器,原因是二氧化硅与碳酸钠高温下反应生成硅酸钠和二氧化碳;
(2)由以上分析可知滤渣1含Fe2O3,滤渣2含有Al(OH)3、H2SiO3,滤渣中含量最多的金属元素是铝元素;
(3)④中调节pH发生2CrO42+2H+Cr2O72+H2O,则步骤④调滤液2的pH使之变小,增大氢离子浓度,平衡正向移动,利于生成Cr2O72;
(4)向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体,步骤⑤发生Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,反应类型是复分解反应;
(5)步骤7中涉及的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O。


科目:高中化学 来源: 题型:
【题目】“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中的没食子儿茶素(EGC)结构如图所示.关于EGC的下列叙述中正确的是( )
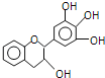
A.EGC的分子式为C15H14O5,属于芳香烃类化合物
B.1molEGC与4molNaOH恰好完全反应
C.该物质能够发生取代反应、加成反应、氧化反应、还原反应、显色反应
D.分子中所有的原子处在同一个平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型钙钛矿太阳能电池具备更加清洁、便于应用、制造成本低和效率高等显著优点。 一种钙钛矿太阳能电池材料的晶胞如图所示。
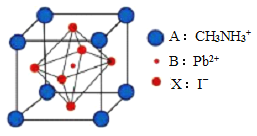
请按要求回答下列有关问题:
(1)构成 CH3NH3 的三种元素中电负性最小的是_____________; 写出碳原子的电子排布式为__________。
(2)Pb 与 C 同主族,比 C 的周期序数大 4,写出 Pb 原子最外层电子的轨道表示式(即电子排布图)__________________。
(3)有关 NH3 的结构与性质探究
① NH3 分子中所含化学键是____________(从“极性键”、“非极性键”、“配位键”、 “离子键”、“σ键”或“ π键”中选填符合的名称);N 原子的杂化形式为__________。
② NH3 分子的 VSEPR 模型名称为_________,分子的空间结构(即立体构型) 为______。
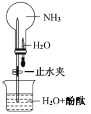
③如图所示,探究 NH3 的性质时,打开止水夹,挤压胶头滴管,可以观察到烧瓶中迅速产生红色喷泉。请用必要的分子结构 与性质的知识和化学用语解释产生该现象的原因:_________、________。
(4)该钙钛矿太阳能电池材料的化学式为________________;该晶胞中,与 I- 紧邻的 I- 个数为_____________; 测定其晶体结构特征最可靠的方法是____________实验。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、M、G五种元素,是分属三个短周期并且原子序数依次增大的主族元素。其中X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。在熔融状态下,将Z的单质和FeG2(元素G和铁构成的某化合物)组成一个可充电电池(装置示意图如下),反应原理为:2Z +FeG2![]() Fe+2ZG
Fe+2ZG
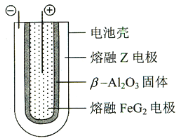
放电时,电池的正极反应式为:______________;充电时,接电源负极的电极材料是____(写物质名称),该电池的电解质为_______(填写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是中学化学中常见的气体,其用途广泛。
(1)工业上氨气可以由氢气和氮气合成。
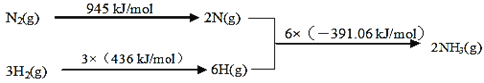
①该反应的热化学方程式是___。
②450℃,将5molN2和5molH2充入2L恒容密闭容器中发生反应,5min后达到平衡,N2的转化率为20%,则NH3的化学反应速率v(NH3)=___,该温度下如图所示反应的平衡常数的数值K=___,温度升高,平衡常数K将___(填“增大”、“减小”或“不变”)。
(2)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。
①当氨水中所含氨的物质的量为3mol,吸收标准状况下44.8LSO2时,溶液中的溶质为___。
②已知NH4HSO3溶液显酸性。用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确的是___。
A.c(NH4+)=2c(SO32-)+c(HSO3-)
B.c(NH4+)>c(SO32-)>c(H+)=c(OH-)
C.c(NH4+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
D.c(NH4+)+c(NH3·H2O)=c(SO32-)+c(HSO3-)+c(H2SO3)
(3)氨气是一种富氢燃料,可以直接用于燃料电池,如图是供氨水式燃料电池工作原理:
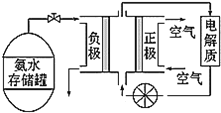
①氨气燃料电池的电解质溶液最好选择___(填“酸性”、“碱性”或“中性”)溶液。
②氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池的总反应方程式为___,正极的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kPa下,碳、氢气、甲烷和辛烷的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、5518kJ/mol,则下列热化学方程式书写正确的是( )
A.C(s)+![]() O2(g)=CO(g) ΔH=-393.5kJ/mol
O2(g)=CO(g) ΔH=-393.5kJ/mol
B.2H2(g)+O2(g)=2H2O(l) ΔH=+571.6kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ/mol
D.C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ/mol
O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g) ΔH1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g) ΔH2
③Sn(s、灰)![]() Sn(s、白) ΔH3=+2.1kJ/mol,下列说法不正确的是( )
Sn(s、白) ΔH3=+2.1kJ/mol,下列说法不正确的是( )
A.灰锡与白锡互为同素异形体
B.锡在常温下以白锡状态存在
C.白锡转化为灰锡的反应是放热反应
D.ΔH1﹥ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分子式为C4H8O2的有机物的同分异构体的说法中,不正确的是
A.能与NaOH溶液反应的同分异构体共有6种
B.存在分子中含有六元环的同分异构体
C.既含有羟基又含有醛基的有5种
D.不存在含有2个羟基的同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机物合成中的重要试剂,为红褐色液体或黄色气体,室温下为不稳定的黄色气体, 具刺鼻恶臭味,遇水分解,某学习小组用 C12 和 NO 制备 NOCl 装置如图。下列说法错误的是
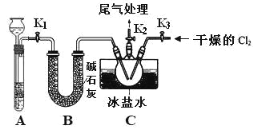
A.氯气在反应中做氧化剂
B.装入药品后,要先打开 K2、K3,反应一段时间后,再打开 K1
C.利用 A 装置还可以做 Na2O2 和水制氧气的实验
D.若没有 B 装置,C 中可能发生反应:2NOCl+H2O=2HCl+NO↑+NO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com