
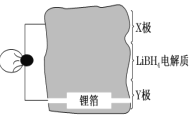
【题目】(1)全固态锂离子电池的结构如图所示,放电时电池反应为 2Li+MgH2=Mg+2LiH。放电时,X 极作_________极。充电时,Y 极反应式为___________。
(2)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子)。
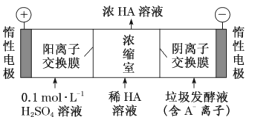
①阳极的电极反应式为 ________________
②简述浓缩室中得到浓乳酸的原理:________________
③电解过程中,采取一定的措施可控制阳极室的 pH 约为 6~8,此时进入浓缩室的OH-可忽略不计。400 mL 10 gL 1 乳酸溶液通电一段时间后,浓度上升为 145 gL 1 (溶液体积变化忽略不计),阴极上产生的 H2 在标准状况下的体积约为_____________L。(乳酸的摩尔质量为90 gmol-1)
【答案】正 LiH + e- = Li +H- 4OH- 4e- = O2↑+ 2H2O 阳极室中的H+穿过阳离子交换膜与阴极室中穿过阴离子交换膜的A-离子在浓缩室结合生成HA 6.72
【解析】
⑴放电时电池反应为 2Li+MgH2 = Mg+2LiH。Li化合价升高失去电子,放电时,作负极,MgH2作正极;
⑵①阳极上阴离子得到电子,即水中的氢氧根得到电子;②阳极室中的H+穿过阳离子交换膜与阴极室中穿过阴离子交换膜的A-离子在浓缩室结合生成HA;③计算乳酸增加的质量,再计算乳酸的物质的量,根据2HA —2A-—H2关系得到阴极上产生的H2的物质的量及体积。
⑴全固态锂离子电池的结构如图所示,放电时电池反应为 2Li+MgH2 = Mg+2LiH。Li化合价升高失去电子,放电时,作负极,MgH2作正极,因此放电时,X极作正极,充电时,Y极为阴极,其电极反应式为LiH + e- = Li +H-,故答案为:正;LiH + e- = Li +H-;
⑵①阳极上阴离子得到电子,即水中的氢氧根得到电子,其电极反应式为4OH- 4e- = O2↑+ 2H2O,故答案为:4OH- 4e- = O2↑+ 2H2O;
②简述浓缩室中得到浓乳酸的原理:阳极室中的H+穿过阳离子交换膜与阴极室中穿过阴离子交换膜的A-离子在浓缩室结合生成HA,故答案为:阳极室中的H+穿过阳离子交换膜与阴极室中穿过阴离子交换膜的A-离子在浓缩室结合生成HA;
③400 mL 10 gL 1 乳酸溶液通电一段时间后,浓度上升为 145 gL 1 (溶液体积变化忽略不计),则增加的乳酸的质量为(145 gL 110 gL 1)×0.4L=54g,增加的乳酸的物质的量为![]() ,根据2HA —2A-—H2关系得到阴极上产生的 H2的物质的量为
,根据2HA —2A-—H2关系得到阴极上产生的 H2的物质的量为![]() ,在标准状况下的体积约为0.3mol×22.4 Lmol 1 = 6.72L,故答案为:6.72。
,在标准状况下的体积约为0.3mol×22.4 Lmol 1 = 6.72L,故答案为:6.72。


科目:高中化学 来源: 题型:
【题目】一定条件下,在恒容密闭容器中进行反应3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g)不能表示上述反应达到化学平衡状态的是( )
Si3N4(s)+12HCl(g)不能表示上述反应达到化学平衡状态的是( )
A.v逆(N2)=3v正(H2)
B.N2和HCl物质的量之比保持不变
C.混合气体密度保持不变
D.每消耗3molSiCl4(g)的同时消耗1molSi3N4(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大苏打(Na2S2O3·5H2O)、苏打、小苏打被称为“苏氏三兄弟”,它们在生活、生产中有广泛应用。
(1)工业上制备苏打是先制备小苏打,写出我国伟大化学家侯德榜提出的制备小苏打的化学方程式___,操作时,往饱和食盐水中先通入气体,先制备小苏打的原因是___。
(2)Na2S2O3标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高,用离子方程式表示其原因__。
(3)工业上,常用纯碱和盐酸除去锅炉中硫酸钙。先用饱和纯碱溶液浸泡锅垢,然后用盐酸清洗。“浸泡”的目的是__。
(4)工业上,将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。写出该反应的化学方程式__。Na2S溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的化学式为__。
(5)在密闭容器中投入一定量的Na2O2和NaHCO3,在300℃下充分反应。若残留固体为纯净物,则起始时![]() 满足的条件是__。
满足的条件是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是一个巨大的资源宝库,海水开发利用的部分过程如图所示。下列有关说法不正确的是( )
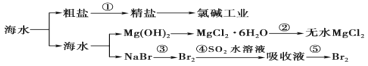
A.①粗盐制精盐除采用过滤泥沙外,还必须除去 Ca2+、Mg2+、SO42-等杂质
B.工业生产中常选用石灰乳作为 Mg2+的沉淀剂,并对沉淀进行洗涤
C.第②步的反应是将 MgCl26H2O 晶体在空气中直接加热脱去结晶水得无水 MgCl2
D.第③步到第⑤步空气吹出法提取海水中溴通常使用 SO2 作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在10mL0.1mol·L1 Na2CO3溶液中逐滴加入0.1mol·L1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示,下列说法不正确的是
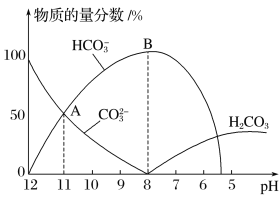
A.溶液的pH为7时,溶液的总体积大于20mL
B.在B点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-)
C.在A点所示的溶液中:c(Na+)=c(CO32-)=c(HCO3-)>c(OH-)>c(H+)
D.已知CO32-水解常数为2×10-4,当溶液中c(HCO3-)=2c(CO32-)时,溶液的pH=10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用如图装置(部分固定装置略去)制备氮化钙(Ca3N2),并探究其实验式。
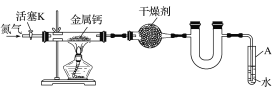
按图连接好实验装置。检查装置的气密性,方法是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(A)=0.5 mol·L-1·s-1B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1D.v(D)=1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示法正确的是( )
A. 由“C(s,石墨)→C(s,金刚石)△H=+119kJ·mol-1”可知金刚石比石墨稳定
B. 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O (1) △H=-285.8kJ·mol-1
C. 在101kPa时,1mol碳燃烧所放出的热量为碳的燃烧热
D. 等量的磷蒸气和磷固体分别完全燃烧,前者放出的热量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】月球上的每百吨He聚变所释放出的能量相当于目前人类一年消耗的能量,地球上氦元素主要以He的形式存在。已知一个12C原子的质量为a g,一个He原子的质量为b g,NA为阿伏加德罗常数。下列说法正确的是
A.He比H多一个中子B.氦元素的近似相对原子质量为3
C.He的相对原子质量为![]() D.He的摩尔质量为bNA
D.He的摩尔质量为bNA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com