
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(A)=0.5 mol·L-1·s-1B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1D.v(D)=1 mol·L-1·s-1
科目:高中化学 来源: 题型:
【题目】常温下,在某200mL的稀硫酸和稀硝酸的混合溶液中逐量地加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。(设硝酸只被还原为NO气体,Fe的相对原子质量为56)。下列有关分析错误的是
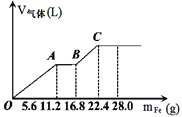
A.原混合酸中NO3-的物质的量为0.2mol
B.原混合酸中H2SO4物质的量浓度为2mol/L
C.OA段与BC段反应中电子转移的物质的量之比为2:1
D.取20mL原混合酸加水稀释至1L后溶液的pH=1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示。

根据以上条件,回答下列问题:
(1)A与B反应生成C的化学方程式为__;低温下_(填“是”或“否”)有利于该反应自发进行。
(2)一定条件下,在密闭容器中进行上述反应,已知A、B、C的起始浓度分别为0.1mol/L、0.4mol/L、0.2mol/L,当反应达到平衡时,B的浓度范围是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
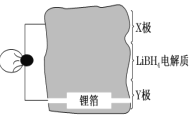
【题目】(1)全固态锂离子电池的结构如图所示,放电时电池反应为 2Li+MgH2=Mg+2LiH。放电时,X 极作_________极。充电时,Y 极反应式为___________。
(2)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子)。
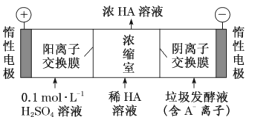
①阳极的电极反应式为 ________________
②简述浓缩室中得到浓乳酸的原理:________________
③电解过程中,采取一定的措施可控制阳极室的 pH 约为 6~8,此时进入浓缩室的OH-可忽略不计。400 mL 10 gL 1 乳酸溶液通电一段时间后,浓度上升为 145 gL 1 (溶液体积变化忽略不计),阴极上产生的 H2 在标准状况下的体积约为_____________L。(乳酸的摩尔质量为90 gmol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予了锂离子电池开发的三位科学家。一种锂离子电池的反应式为LixC6+Li1-xCoO2![]() C6+LiCoO2(x<1)。其工作原理如图所示。下列说法不正确的是( )
C6+LiCoO2(x<1)。其工作原理如图所示。下列说法不正确的是( )
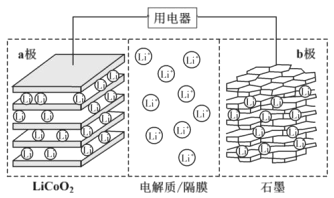
A.放电时,Li+由b极向a极迁移
B.放电时,若转移0.02mol电子,石墨电极将减重0.14g
C.充电时,a极接外电源的正极
D.该废旧电池进行“充电处理”有利于锂在LiCoO2极回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋(Bi)及其化合物广泛应用于电子、医药等领域。一种以含铋矿石辉铋矿(主要成分为Bi2S3,含少量杂质PbO2等)为原料,采用湿法冶金制备铋单质的工艺流程如下:
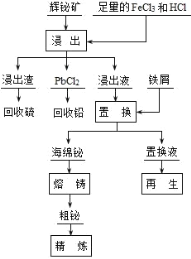
已知:PbCl2是一种难溶于冷水,易溶于热水的白色固体。 回答下列问题:
(1)铋(Bi)位于ⅤA族,铋的氢化物的热稳定性______氨气(填“大于”或“小于”)。
(2)“浸出”时,为了提高浸出速率,可采用的措施有______(任写一条)
(3)加热浸出时,PbO2 生成 PbCl2 和一种气体,此反应的化学方程式为______, 从产物中分离回收 PbCl2 的步骤是______、洗涤、干燥。从保护环境和原料循环利 用的角度,请指出上述工艺流程中可以采取的措施为______。
(4)电解精炼粗铋时必须补充含 Bi3+浓度高的电解液。可用粗铋、铅条作为两个电极,铅条外用素烧 的陶瓷坩埚作隔膜(Bi3+不能透过,H+能透过),电解液开始时为盐酸和食盐的混合液。则粗铋为电解池的 ______极,电解总反应为______。
(5)25℃时,向浓度均为 0.02mol·L-1 的 Cu2+、Bi3+的混合溶液中滴加 Na2S 溶液(设溶液体积增加 1倍),使 Cu2+恰好沉淀完全即溶液中 c(Cu2+)=1×10-5 mol·L-1,此时是否有 Bi2S3 沉淀生成______(列式计算说明)。(已知:25℃时,Ksp(CuS)=6.0×10-36、Ksp(Bi2S3)=1.8×10-99)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向淀粉-碘化钾的酸性溶液中加入少量 H2O2 溶液,溶液立即变蓝,再向蓝色溶液中缓慢通入足量的 SO2, 蓝色逐渐消失。下列判断不正确的是
A.根据上述实验判断 H2O2 和 SO2 反应能生成强酸
B.蓝色逐渐消失,体现了 SO2 的漂白性
C.SO2 中 S 原子采取 sp2杂化方式,分子的空间构型为 V 型
D.H2O2是一种含有极性键和非极性键的极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业中很多重要的原料都是来源于石油化工,回答下列问题
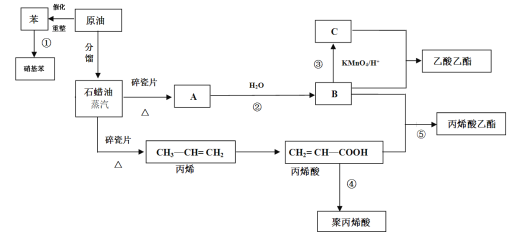
(1)C的结构简式为________。
(2)③④反应的反应类型分别为_____________、___________。
(3)丙烯酸(CH2 = CH — COOH)可能发生的反应有____________(填序号)
A 加成反应 B 取代反应 C 加聚反应 D 中和反应 E 氧化反应
(4)写出下列反应方程式
①反应①的化学方程式__________________________________________________;
②反应②的化学方程式__________________________________________________;
③反应⑤的化学方程式__________________________________________________。
(5)丙烯分子中最多有______个原子共面。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳链增长的反应是有机合成一个重要方法,其中一个重要的反应如图:

(1)有机物A的含氧官能团名称是__;有机物B的分子式是__;
(2)按要求写出有机物A的所有同分异构体:有苯环,和A有相同的官能团__;
(3)有机物C和乙醇反应的化学方程式为(不要求写反应条件)__;
(4)有机物B其中一种制备方法如图:
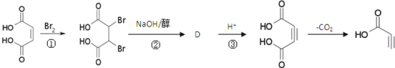
①反应①的反应类型是__;
②写出反应②的化学方程式__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com