
����Ŀ������ۣ��⻯�ص�������Һ�м������� H2O2 ��Һ����Һ����������������ɫ��Һ�л���ͨ�������� SO2�� ��ɫ����ʧ�������жϲ���ȷ����
A.��������ʵ���ж� H2O2 �� SO2 ��Ӧ������ǿ��
B.��ɫ����ʧ�������� SO2 ��Ư����
C.SO2 �� S ԭ�Ӳ�ȡ sp2�ӻ���ʽ�����ӵĿռ乹��Ϊ V ��
D.H2O2��һ�ֺ��м��Լ��ͷǼ��Լ��ļ��Է���
���𰸡�B
��������
A�������-�⻯�ص�������Һ�м�������H2O2��Һ����Һ����������������H2O2+2I-+2H+�TI2+2H2O˵��H2O2���������ԣ�������ɫ��Һ�л���ͨ��������SO2����ɫ����ʧ��������SO2+I2+2H2O�TSO42-+2I-+4H+��˵��SO2���л�ԭ�ԣ�����H2O2��SO2���Է�Ӧ��������Ϊǿ�ᣬ��A��ȷ��
B��������ɫ��Һ�л���ͨ��������SO2����ɫ����ʧ��������SO2+I2+2H2O�TSO42-+2I-+4H+��������SO2�Ļ�ԭ�ԣ���B����
C��SO2�ļ۲���ӶԸ���=2+![]() (6-2��2)=3���µ��Ӷ���Ϊ1����ԭ�Ӳ�ȡsp2�ӻ����÷���ΪV�νṹ����C��ȷ��
(6-2��2)=3���µ��Ӷ���Ϊ1����ԭ�Ӳ�ȡsp2�ӻ����÷���ΪV�νṹ����C��ȷ��
D��H2O2������O-OΪ�Ǽ��Լ���O-H��Ϊ���Լ���H2O2��չ����ҳ�ͽṹ�������ʽṹ���Գƣ�����������IJ��غϣ�Ϊ���Է��ӣ���D��ȷ��
��ѡ��B��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳ�����ѹ�����º����10m3�ļ״��ϳ����У��ڴ����������½��м״��ϳɣ���Ҫ��Ӧ�ǣ�2H2(g) + CO(g)![]() CH3OH(g)+181.6kJ����֪��ij�¶��£����¶�ΪT1�棩�˷�Ӧ��ƽ�ⳣ��Ϊ160��
CH3OH(g)+181.6kJ����֪��ij�¶��£����¶�ΪT1�棩�˷�Ӧ��ƽ�ⳣ��Ϊ160��
(1)���¶��£����ܱ������м���һ������CO��H2����Ӧ��ijʱ�̲�ø���ֵ�Ũ�������
���� | H2 | CO | CH3OH |
Ũ��/��mol/L�� | 0.2 | 0.1 | 0.4 |
�Ƚϴ�ʱ�����淴Ӧ���ʵĴ�С��v��_______v�� ������>������<��������������������������ͬ�����CO��H2����T2�������·�Ӧ��10 min���ƽ��ʱc(H2)��0.4mol/L�����ʱ���ڷ�Ӧ����v(CH3OH)��_______ mol/(L��min)��
(2)��һ���������ܱպ��ݵ������У�����ʽ�ӻ����������ܱ�ʾ������Ӧ�ﵽ��ѧƽ��״̬����_______��ѡ����ţ���
a��2v��(CO) = v��(H2)
b��c(CO): c(H2):c(CH3OH) =1:2:1
c����������ƽ��ʽ�����ֲ���
d�����������ܶȱ��ֲ���
(3)������Ӧ�ﵽƽ�������˵����ȷ����_______��ѡ����ţ���
a�������������䣬����ѹǿ��ƽ�ⳣ��K��160
b�������������䣬�¶����ߣ�ƽ�ⳣ��K���С
c�������������䣬��ͬ����������CO��H2����ƽ�ⲻ�ᷢ���ƶ�
d�������������䣬����״������ʵ���������Ӧ����Ҳ����֮������
(4)Ѱ�Һ��ʵĴ��������������ϳɼ״�������һֱ���о����⡣�ֱַ��X��Y��Z���ִ�����������ʵ�飨������������ͬ����
��X��T1��ʱ��Ч����ߣ���ʹ����Ӧ���ʼӿ�Լ3��105����
��Y��T2��ʱ��Ч����ߣ���ʹ����Ӧ���ʼӿ�Լ3��105����
��Z��T3��ʱ��Ч����ߣ���ʹ�淴Ӧ���ʼӿ�Լ1��106����
��֪��T1��T2��T3������������Ϣ������Ϊ��������Ӧ��ѡ������˴�������������____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���10mL0.1mol��L1 Na2CO3��Һ����μ���0.1mol��L1 HCl��Һ����Һ��pH���ͣ���ʱ��Һ�к�̼�������ʵ��������仯��ͼ��ʾ������˵������ȷ����
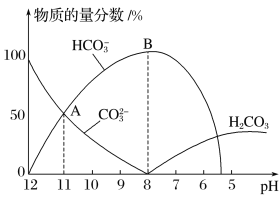
A.��Һ��pHΪ7ʱ����Һ�����������20mL
B.��B����ʾ����Һ�У�c(Na+)+c(H+)��2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-)
C.��A����ʾ����Һ�У�c(Na+)��c(CO32-)��c(HCO3-)>c(OH-)>c(H+)
D.��֪CO32-ˮ�ⳣ��Ϊ2��10��4������Һ��c(HCO3-)��2c(CO32-)ʱ����Һ��pH��10
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2A(g)+B(g)![]() 3C(g)+4D(g)��Ӧ�У���ʾ�÷�Ӧ����������(�� ��)
3C(g)+4D(g)��Ӧ�У���ʾ�÷�Ӧ����������(�� ��)
A.v(A)=0.5 mol��L-1��s-1B.v(B)=0.3 mol��L-1��s-1
C.v(C)=0.8 mol��L-1��s-1D.v(D)=1 mol��L-1��s-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ˮ�ĵ���ƽ��������ͼʾ���Իش��������⣺
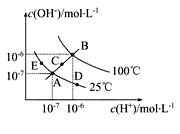
��1��ͼ�����Kw��Ĺ�ϵ��_________��
��2������A�㵽D�㣬�ɲ��õĴ�ʩ��_________��
A ���� B �������������� C ����������NH4Cl
��3��B��Ӧ�¶��£���pH=11�Ŀ�������ҺV1 L��0.05mol/L��ϡ����V2L ��ϣ�����ǰ����Һ��������䣩�����û����Һ��pH=2���� V1��V2=________________��
��4�������£���V mL��0.1000mol��L-1����������Һ��μ��뵽20.00mL��0.1000mol��L-1������Һ�г�ַ�Ӧ����ش��������⣨������Һ����ı仯��
�������ҺpH=7����ʱV��ȡֵ___________20.00������>����<������������������Һ ��c(Na+)��c(CH3COO-)��c(H+)��c(OH-)�Ĵ�С��ϵΪ___________��
�����V=40.00�����ʱ��Һ��c(OH-)-c(H+)-c(CH3COOH)=________mol��L-1�������ݣ�
��5����0.10 mol��L-1����ͭ��Һ�м�����������ϡ��Һ��ֽ��裬��dz��ɫ������ͭ�������ɣ�����Һ��pH��8ʱ��c(Cu2+)��____________mol��L-1����Ksp[Cu(OH)2]��2.2��10-20��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����ʾ����ȷ���ǣ� ��
A. �ɡ�C��s��ʯī����C��s�����ʯ����H=+119kJ��mol-1����֪���ʯ��ʯī�ȶ�
B. ��101kPaʱ��2gH2��ȫȼ������Һ̬ˮ���ų�285.8kJ������������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ��2H2(g)+O2(g)=2H2O (1) ��H=-285.8kJ��mol-1
C. ��101kPaʱ��1mol̼ȼ�����ų�������Ϊ̼��ȼ����
D. ������������������ֱ���ȫȼ�գ�ǰ�߷ų���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������к��зḻ�ĵ⡣Ϊ�˴Ӻ�������ȡ�⣬ij�о���ѧϰС����Ʋ�����������ʵ�飺
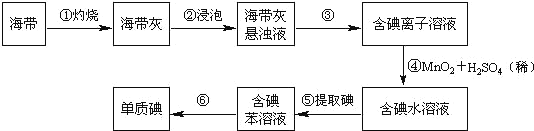
����д���пհף�
��1����������պ���ʱ������Ҫ���ż��⣬����Ҫ�õ���ʵ��������_______��������������ѡ�������һЩ�������ñ����ĸ��д�ڿհ״�����
A���ձ� B������ C�������� D�������� E���ƾ��� F��������
��2������۵�ʵ�����������______________�������Ŀ���ǴӺ��ⱽ��Һ�з�������ʵ�ͻ��ձ����ò����ʵ�����������______________��
��3������ܷ�Ӧ�����ӷ���ʽΪ_______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ�� X��Y��Z��W ԭ����������������X �ǵؿ��к�������Ԫ����Y ԭ�ӵ������ֻ��һ��������Z λ��Ԫ�����ڱ���A����W ��X����ͬһ���塣����˵����ȷ����
A. ԭ�Ӱ뾶��r(W) > r(Z) > r(Y)
B. ��X��Y ��ɵĻ������о��������ۼ�
C. Y ������������ˮ����ļ��Ա�Z����
D. X �ļ���̬�⻯������ȶ��Ա�W��ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����T�������£���lL�̶�������ܱ�����M�м���2molX��lmolY���������·�Ӧ��2X(g)+Y(g)![]() aZ(g)+W(g) ��H=-QkJ��mol-1(Q>0)������Ӧ�ﵽƽ��ų�������ΪQ1kJ����ƽ����������¶ȣ���������ƽ����Է���������С��ά���¶�T�治�䣬����ʼʱ������M�м������ʵ����ʵ������£���Ӧ�ﵽƽ���ų���������ΪQ1kJ���ǣ� ��
aZ(g)+W(g) ��H=-QkJ��mol-1(Q>0)������Ӧ�ﵽƽ��ų�������ΪQ1kJ����ƽ����������¶ȣ���������ƽ����Է���������С��ά���¶�T�治�䣬����ʼʱ������M�м������ʵ����ʵ������£���Ӧ�ﵽƽ���ų���������ΪQ1kJ���ǣ� ��
A.2molX��1molY��1molAr
B.amolZ��1molW
C.1molX��0.5molY��0.5amolZ��0.5molW
D.2molX��1molY��1molZ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com