
【题目】合成气经压缩升温后进入10m3的甲醇合成塔中,在催化剂的作用下进行甲醇合成,主要反应是:2H2(g) + CO(g)![]() CH3OH(g)+181.6kJ。已知:某温度下(设温度为T1℃)此反应的平衡常数为160。
CH3OH(g)+181.6kJ。已知:某温度下(设温度为T1℃)此反应的平衡常数为160。
(1)此温度下,在密闭容器中加入一定量的CO和H2,反应到某时刻测得各组分的浓度如表:
物质 | H2 | CO | CH3OH |
浓度/(mol/L) | 0.2 | 0.1 | 0.4 |
比较此时正、逆反应速率的大小:v正_______v逆 (填“>”、“<”或“=”);若加入与上述同样多的CO和H2,在T2℃条件下反应,10 min后达平衡时c(H2)=0.4mol/L,则该时间内反应速率v(CH3OH)=_______ mol/(L·min);
(2)在一定条件的密闭恒容的容器中,下列式子或文字描述能表示上述反应达到化学平衡状态的是_______(选填序号);
a.2v逆(CO) = v正(H2)
b.c(CO): c(H2):c(CH3OH) =1:2:1
c.混合气体的平均式量保持不变
d.混合气体的密度保持不变
(3)上述反应达到平衡后,下列说法正确的是_______(选填序号);
a.其他条件不变,增大压强,平衡常数K﹤160
b.其他条件不变,温度升高,平衡常数K会减小
c.其他条件不变,若同比例地增加CO和H2的量平衡不会发生移动
d.其他条件不变,增大甲醇的物质的量,正反应速率也会随之逐渐增大
(4)寻找合适的催化剂来改善上述合成甲醇的条件一直是研究课题。现分别对X、Y、Z三种催化剂进行如下实验(其他条件均相同):
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂并简述理由____。
【答案】> 0.03 ac bd Z,温度要求低,反应速率快
【解析】
(1)根据浓度商与K的大小比较判断;先根据表中数据计算H2的起始浓度,然后计算v(H2),根据速率之比等于化学计量数之比计算;
(2)依据反应特征和平衡标志分析,正逆反应速率相同,各组分含量保持不变分析;
(3)a.其他条件不变,增大压强,平衡常数不变;
b.其他条件不变,温度升高,反应是放热反应,平衡逆向进行,平衡常数K会减小;
c.其他条件不变,若同比例地增加CO和H2的量,相当于增大压强,平衡正向进行;
d.其他条件不变,增大甲醇的物质的量,平衡逆向进行,正逆反应速率也会随之逐渐增大;
(4)根据题给温度和催化剂对反应速率的影响对比分析。
(1)某时刻的Qz=![]() =
=![]() =100<160,反应正向进行,v正>v逆;某时刻CH3OH的浓度为0.4mol/L,则H2的起始浓度为0.2mol/L+0.4mol/L×2=1mol/L,在T2℃反应10min时间内v(H2)=
=100<160,反应正向进行,v正>v逆;某时刻CH3OH的浓度为0.4mol/L,则H2的起始浓度为0.2mol/L+0.4mol/L×2=1mol/L,在T2℃反应10min时间内v(H2)=![]() =0.06mol/(L·min),则v(CH3OH)=
=0.06mol/(L·min),则v(CH3OH)=![]() v(H2)=0.03mol/(L·min),故答案为:>,0.03mol/(L·min);
v(H2)=0.03mol/(L·min),故答案为:>,0.03mol/(L·min);
(2)2H2(g)+CO(g)CH3OH(g)+181.6kJ,反应是气体体积减小的放热反应;
a. 反应速率之比等于化学方程式计量数之比,2v逆(CO)=v正(H2),说明一氧化碳正逆反应速率相同,说明反应达到平衡状态,故a正确;
b. c(CO): c(H2):c(CH3OH)=1:2:1,只能说明浓度比等于反应比,和起始量变化量有关,不能说明反应达到平衡,故b错误;
c.反应前后气体物质的量减小,质量不变,混合气体的平均式量保持不变,说明反应达到平衡状态,故c正确;
d.反应前后气体质量和体积不变,混合气体的密度始终保持不变,不能说明反应达到平衡状态,故d错误;故答案为:ac;
(3)a.其他条件不变,增大压强,平衡常数不变,故a错误;
b.其他条件不变,温度升高,反应是放热反应,平衡逆向进行,平衡常数K会减小,故b正确;
c.其他条件不变,若同比例地增加CO和H2的量,相当于增大压强,平衡正向进行,故c错误;
d.其他条件不变,增大甲醇的物质的量,增大生成物浓度,平衡逆向进行,正逆反应速率也会随之逐渐增大,故d正确;故答案为:bd;
(4)因为T1>T2>T3,所以温度越低平衡常数越大,反应物转化率越大,又催化剂同等程度加快反应速率,所以既能在低温下作用又能加快反应速率的催化剂最好选用Z,故答案为:Z,温度要求低,反应速率快。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0. 100mol·L-1的NaOH溶液分别滴定10.00mL浓度均为0.100mol·L-1的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是
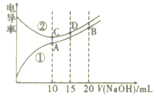
A.曲线②代表滴定CH3COOH溶液的曲线
B.在相同温度下,C、D两点溶液中水的电离程度: C>D
C.取A点溶液1mL加水稀释,溶液中的所有离子浓度都减小
D.B点溶液中: c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸甲酯催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式为: CH3COOCH3(l) +C6H13OH (l) ![]() CH3COOC6H13(l) +CH3OH(l)
CH3COOC6H13(l) +CH3OH(l)
反应开始时,己醇和乙酸甲酯按物质的量之比 1:1 投料,测得 348 K、343 K 两个温度 下乙酸甲酯转化率(α)随时间(t)的变化关系如下图所示:
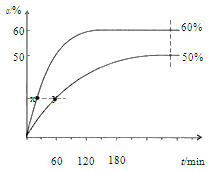
下列说法不正确的是
A.该醇解反应的ΔH > 0
B.反应速率:v(x)> v(y)
C.343K时,以物质的量分数表示的化学平衡常数 Kx=2.25
D.348K时,初始投料![]() 分别按 1:1和2:1进行,Kx 相同
分别按 1:1和2:1进行,Kx 相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在某200mL的稀硫酸和稀硝酸的混合溶液中逐量地加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。(设硝酸只被还原为NO气体,Fe的相对原子质量为56)。下列有关分析错误的是
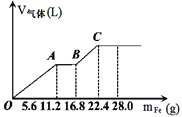
A.原混合酸中NO3-的物质的量为0.2mol
B.原混合酸中H2SO4物质的量浓度为2mol/L
C.OA段与BC段反应中电子转移的物质的量之比为2:1
D.取20mL原混合酸加水稀释至1L后溶液的pH=1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在15mL0.lmol/LKOH溶液中逐滴加入0.2mol/L甲酸(HCOOH,弱酸)溶液,溶液pH和加入甲酸的体积关系曲线如图所示,下列关系正确的是
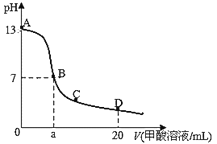
A.在B点:c(K+)=c(HCOO-)>c(OH-)=c(H+),且a=7.5
B.在A、B间任意一点,c(HCOO-)>c(K+)>c(OH-)>c(H+)
C.B→C段:水的电离程度先增大后减小
D.在D点:c(HCOO-)+c(HCOOH)>2c(K+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.含0.1molFeI2的溶液中通入0.125molCl2:2Fe2++8I-+5Cl2=2Fe3++4I2+10Cl-
B.浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+![]() Fe3++3NO2↑+3H2O
Fe3++3NO2↑+3H2O
C.Cu溶于稀HNO3:Cu+2H++NO3-=Cu2++NO2↑+H2O
D.氢氧化铁中加入过量氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含MgCl2、AlCl3均为nmol的混合液,向其中滴加NaOH溶液至过量。有关离子沉淀或沉淀溶解与pH的关系如下表。加入NaOH的物质的量与生成沉淀的物质的量的关系正确的是( )
离子 | Mg2+ | Al3+ | 物质 | Al(OH)3 |
开始沉淀pH | 8.93 | 3.56 | 开始溶解pH | 8.04 |
完全沉淀pH | 10.92 | 4.89 | 完全溶解pH | 12.04 |
A. B.
B.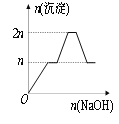
C.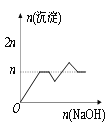 D.
D.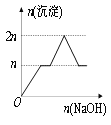
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示。

根据以上条件,回答下列问题:
(1)A与B反应生成C的化学方程式为__;低温下_(填“是”或“否”)有利于该反应自发进行。
(2)一定条件下,在密闭容器中进行上述反应,已知A、B、C的起始浓度分别为0.1mol/L、0.4mol/L、0.2mol/L,当反应达到平衡时,B的浓度范围是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向淀粉-碘化钾的酸性溶液中加入少量 H2O2 溶液,溶液立即变蓝,再向蓝色溶液中缓慢通入足量的 SO2, 蓝色逐渐消失。下列判断不正确的是
A.根据上述实验判断 H2O2 和 SO2 反应能生成强酸
B.蓝色逐渐消失,体现了 SO2 的漂白性
C.SO2 中 S 原子采取 sp2杂化方式,分子的空间构型为 V 型
D.H2O2是一种含有极性键和非极性键的极性分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com