
【题目】下列离子方程式正确的是( )
A.含0.1molFeI2的溶液中通入0.125molCl2:2Fe2++8I-+5Cl2=2Fe3++4I2+10Cl-
B.浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+![]() Fe3++3NO2↑+3H2O
Fe3++3NO2↑+3H2O
C.Cu溶于稀HNO3:Cu+2H++NO3-=Cu2++NO2↑+H2O
D.氢氧化铁中加入过量氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
【答案】A
【解析】
A.含0.1molFeI2的溶液中滴加含0.125molCl2的氯水,还原性I>Fe2+,依据所给量可知2I+Cl2=I2+2Cl,0.2molI消耗0.1mol Cl2,剩余的0.025mol Cl2发生2Fe2++Cl2=2Fe3++2Cl-反应,能够氧化0.05mol亚铁离子,即参加反应的碘离子为亚铁离子的4倍,该反应的离子方程式为:2Fe2++8I+5Cl2=2Fe3++4I2+10Cl,故A正确;
B.浓硝酸与过量铁粉共热反应生成硝酸亚铁,反应的离子方程式为:Fe+2NO3+4H+ ![]() Fe2++2NO2↑+2H2O,故B错误;
Fe2++2NO2↑+2H2O,故B错误;
C.铜和稀硝酸反应生成硝酸铜、一氧化氮和水,反应的离子方程式为3Cu+8H++2NO3═3Cu2++2NO↑+4H2O,故C错误;
D.Fe(OH)3与氢碘酸反应生成碘化亚铁、单质碘和水,反应的离子方程式为2I+2Fe(OH)3+6H+═2Fe2++6H2O+I2,故D错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】已知:含C=C的物质(烯烃)一定条件下能与水发生加成反应,生成醇(含羟基的烃的衍生物);有机物A-D间存在图示的转化关系。下列说法不正确的是
![]()
A.D结构简式为CH3COOCH2CH3B.A能使酸性高锰酸钾溶液褪色
C.B与乙酸发生了取代反应D.可用B萃取碘水中的碘单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在恒容密闭容器中进行反应3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g)不能表示上述反应达到化学平衡状态的是( )
Si3N4(s)+12HCl(g)不能表示上述反应达到化学平衡状态的是( )
A.v逆(N2)=3v正(H2)
B.N2和HCl物质的量之比保持不变
C.混合气体密度保持不变
D.每消耗3molSiCl4(g)的同时消耗1molSi3N4(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列给定条件的溶液中,一定能大量共存的离子组是( )
A.使pH试纸显深蓝色的溶液:Ca2+、NH4+、HCO3-、Cl-
B.室温下,![]() =0.1mol/L的溶液:Na+、K+、SiO32-、NO3-
=0.1mol/L的溶液:Na+、K+、SiO32-、NO3-
C.含FeCl3的溶液:K+、Na+、SO42-、CO32-
D.能与金属铝反应放出氢气的溶液:Mg2+、Na+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气经压缩升温后进入10m3的甲醇合成塔中,在催化剂的作用下进行甲醇合成,主要反应是:2H2(g) + CO(g)![]() CH3OH(g)+181.6kJ。已知:某温度下(设温度为T1℃)此反应的平衡常数为160。
CH3OH(g)+181.6kJ。已知:某温度下(设温度为T1℃)此反应的平衡常数为160。
(1)此温度下,在密闭容器中加入一定量的CO和H2,反应到某时刻测得各组分的浓度如表:
物质 | H2 | CO | CH3OH |
浓度/(mol/L) | 0.2 | 0.1 | 0.4 |
比较此时正、逆反应速率的大小:v正_______v逆 (填“>”、“<”或“=”);若加入与上述同样多的CO和H2,在T2℃条件下反应,10 min后达平衡时c(H2)=0.4mol/L,则该时间内反应速率v(CH3OH)=_______ mol/(L·min);
(2)在一定条件的密闭恒容的容器中,下列式子或文字描述能表示上述反应达到化学平衡状态的是_______(选填序号);
a.2v逆(CO) = v正(H2)
b.c(CO): c(H2):c(CH3OH) =1:2:1
c.混合气体的平均式量保持不变
d.混合气体的密度保持不变
(3)上述反应达到平衡后,下列说法正确的是_______(选填序号);
a.其他条件不变,增大压强,平衡常数K﹤160
b.其他条件不变,温度升高,平衡常数K会减小
c.其他条件不变,若同比例地增加CO和H2的量平衡不会发生移动
d.其他条件不变,增大甲醇的物质的量,正反应速率也会随之逐渐增大
(4)寻找合适的催化剂来改善上述合成甲醇的条件一直是研究课题。现分别对X、Y、Z三种催化剂进行如下实验(其他条件均相同):
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂并简述理由____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
①Al2O3![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3
Al(OH)3
②S![]() SO3
SO3![]() H2SO4
H2SO4
③饱和NaCl(aq)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
④Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() 无水FeCl3
无水FeCl3
⑤MgCl2(aq) ![]() Mg(OH)2
Mg(OH)2 ![]() MgO
MgO
A.①②③B.②③④C.①③⑤D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大苏打(Na2S2O3·5H2O)、苏打、小苏打被称为“苏氏三兄弟”,它们在生活、生产中有广泛应用。
(1)工业上制备苏打是先制备小苏打,写出我国伟大化学家侯德榜提出的制备小苏打的化学方程式___,操作时,往饱和食盐水中先通入气体,先制备小苏打的原因是___。
(2)Na2S2O3标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高,用离子方程式表示其原因__。
(3)工业上,常用纯碱和盐酸除去锅炉中硫酸钙。先用饱和纯碱溶液浸泡锅垢,然后用盐酸清洗。“浸泡”的目的是__。
(4)工业上,将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。写出该反应的化学方程式__。Na2S溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的化学式为__。
(5)在密闭容器中投入一定量的Na2O2和NaHCO3,在300℃下充分反应。若残留固体为纯净物,则起始时![]() 满足的条件是__。
满足的条件是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是一个巨大的资源宝库,海水开发利用的部分过程如图所示。下列有关说法不正确的是( )
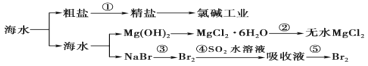
A.①粗盐制精盐除采用过滤泥沙外,还必须除去 Ca2+、Mg2+、SO42-等杂质
B.工业生产中常选用石灰乳作为 Mg2+的沉淀剂,并对沉淀进行洗涤
C.第②步的反应是将 MgCl26H2O 晶体在空气中直接加热脱去结晶水得无水 MgCl2
D.第③步到第⑤步空气吹出法提取海水中溴通常使用 SO2 作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示法正确的是( )
A. 由“C(s,石墨)→C(s,金刚石)△H=+119kJ·mol-1”可知金刚石比石墨稳定
B. 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O (1) △H=-285.8kJ·mol-1
C. 在101kPa时,1mol碳燃烧所放出的热量为碳的燃烧热
D. 等量的磷蒸气和磷固体分别完全燃烧,前者放出的热量多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com