
【题目】在15mL0.lmol/LKOH溶液中逐滴加入0.2mol/L甲酸(HCOOH,弱酸)溶液,溶液pH和加入甲酸的体积关系曲线如图所示,下列关系正确的是
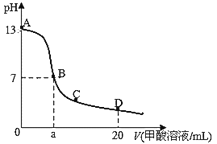
A.在B点:c(K+)=c(HCOO-)>c(OH-)=c(H+),且a=7.5
B.在A、B间任意一点,c(HCOO-)>c(K+)>c(OH-)>c(H+)
C.B→C段:水的电离程度先增大后减小
D.在D点:c(HCOO-)+c(HCOOH)>2c(K+)
【答案】D
【解析】
A.当恰好中和时消耗0.2mol/L甲酸溶液7.5mL,反应生成甲酸钠溶液,甲酸钠水解,溶液显示碱性,若溶液为中性,则c(OH-)=c(H+),根据电荷守恒c(K+)=c(HCOO-),由于溶液中存在部分甲酸,则应该满足a>7.5,故A错误;
B.在A、B间任意一点,开始存在c(OH-)>c(HCOO-),因此可能存在:c(K+)>c(OH-)>c(HCOO-)>c(H+),故B错误;
C.B点是甲酸钾和甲酸的混合溶液,在C点甲酸过量,溶液呈酸性,抑制水的电离,B→C段,酸的浓度增大,水电离程度减小,即水的电离程度一直减小,故C错误;
D.D点甲酸过量,所加入甲酸的物质的量为:0.02L×0.2mol/L═0.004mol,KOH的物质的量为:0.015L×0.1mol/L=0.0015mol,根据物料守恒,则反应后溶液中一定满足:c(HCOO-)+c(HCOOH)>2c(K+),故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。
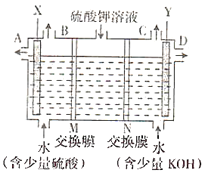
(1)X极与电源的________(填“正”或“负”)极相连。氢气从________(填“B”或“C”)口导出。
(2)已知离子交换膜只允许某类离子通过,则M为________(填“阴离子”或“阳离子”)交换膜。
(3)若制得氧气5.6L(标准状况),则生成氢氧化钾的质量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb)
酸或碱 | 电离平衡常数(Ka或Kb) |
CH3COOH | 1.8×10-5 |
HNO2 | 4.6×10-4 |
HCN | 5×10-10 |
HClO | 3×10-8 |
NH3H2O | 1.8×10-5 |
下表是常温下几种难(微)溶物的溶度积常数(Ksp):
难(微)溶物 | 溶度积常数(Ksp) |
BaSO4 | 1×10-10 |
BaCO3 | 2.6×10-9 |
CaSO4 | 7×10-5 |
CaCO3 | 5×10-9 |
请回答下列问题:
(l)写出HCN的电离方程式:___________,HClO的电子式__________。
(2)表中所给的四种酸中,酸性最强的是__________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大且电离常数改变的操作是__________(填字母序号)。
A.加少量冰酷酸 B.降低温度 C.加水稀释 D.升高温度 E.加少量的CH3COONa固体
(3)CH3COONH4的水溶液呈__________(选填“酸性”、“中性”或“碱性”),该溶液中存在的各离子浓度大小关系是__________。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量BasO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度不小于0.02 mol·L-1,则溶液中CO32-物质的量浓度应≥__________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CPAE是蜂胶的主要活性成分,由咖啡酸合成CPAE的路线如下:
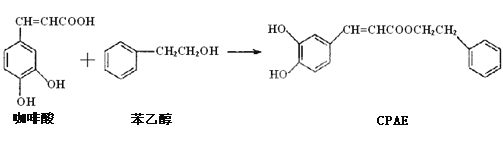 +H2O
+H2O
下列关于上述所列有机物的说法中正确的是( )
A.咖啡酸、CPAE及苯乙醇都能发生取代、加成、氧化及消去反应
B.用FeCl3溶液可以来检测上述反应中是否有CPAE生成
C.苯乙醇是最简单的芳香醇,与邻乙基苯酚互为同系物关系
D.1mol的咖啡酸最多可与4mol Br2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁(Ⅲ)酸钾晶体(K3[Fe(C2O4)3]·3H2O)易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用铁屑为原料制备,相关反应的化学方程式为:
Fe +H2SO4 = FeSO4 +H2↑
FeSO4 + H2C2O4 + 2H2O =FeC2O4·2H2O↓+ H2SO4
2FeC2O4·2H2O + H2O2 + H2C2O4 + 3K2C2O4 = 2K3[Fe(C2O4)3] + 6H2O
回答下列问题:
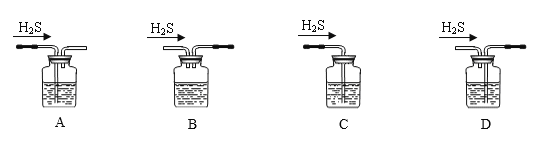
(1)铁屑中常含硫元素,因而在制备FeSO4时会产生有毒的H2S气体,该气体可用氢氧化钠溶液吸收。下列吸收装置正确的是________(选填序号);
(2)在将Fe2+氧化的过程中,需控制溶液温度不高于40℃,理由是________;
(3)得到K3[Fe(C2O4)3]溶液后,再想获得其晶体,常加入_____溶剂(填编号)
a. 冰水 b. 无水乙醇 c. 四氯化碳
(4)晶体中所含结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤重复②~④步,⑥计算。
步骤⑤也被称做________操作,其目的是____________________________;
(5)重量分析法测定时,步骤③未在干燥器中进行,那么测得的晶体中所含结晶水含量________(填“偏高”、“偏低”或“无影响”);
(6)三草酸合铁(Ⅲ)酸钾晶体用重量分析法测定时,2.810g的晶体经操作最终获得了2.480g无水物,则此次测定的相对误差为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气经压缩升温后进入10m3的甲醇合成塔中,在催化剂的作用下进行甲醇合成,主要反应是:2H2(g) + CO(g)![]() CH3OH(g)+181.6kJ。已知:某温度下(设温度为T1℃)此反应的平衡常数为160。
CH3OH(g)+181.6kJ。已知:某温度下(设温度为T1℃)此反应的平衡常数为160。
(1)此温度下,在密闭容器中加入一定量的CO和H2,反应到某时刻测得各组分的浓度如表:
物质 | H2 | CO | CH3OH |
浓度/(mol/L) | 0.2 | 0.1 | 0.4 |
比较此时正、逆反应速率的大小:v正_______v逆 (填“>”、“<”或“=”);若加入与上述同样多的CO和H2,在T2℃条件下反应,10 min后达平衡时c(H2)=0.4mol/L,则该时间内反应速率v(CH3OH)=_______ mol/(L·min);
(2)在一定条件的密闭恒容的容器中,下列式子或文字描述能表示上述反应达到化学平衡状态的是_______(选填序号);
a.2v逆(CO) = v正(H2)
b.c(CO): c(H2):c(CH3OH) =1:2:1
c.混合气体的平均式量保持不变
d.混合气体的密度保持不变
(3)上述反应达到平衡后,下列说法正确的是_______(选填序号);
a.其他条件不变,增大压强,平衡常数K﹤160
b.其他条件不变,温度升高,平衡常数K会减小
c.其他条件不变,若同比例地增加CO和H2的量平衡不会发生移动
d.其他条件不变,增大甲醇的物质的量,正反应速率也会随之逐渐增大
(4)寻找合适的催化剂来改善上述合成甲醇的条件一直是研究课题。现分别对X、Y、Z三种催化剂进行如下实验(其他条件均相同):
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂并简述理由____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为( )
A.920 kJB.557 kJC.188 kJD.436 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。请回答下列问题:

(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B。则B的化学式为__。
(2)若D是氯碱工业的主要产品之一,B有两性,则反应②的离子方程式是__。
(3)若A、C、D都是常见气体,C是导致酸雨的主要气体,则反应③的化学方程式为___。
(4)若A的焰色反应呈黄色,D为二氧化碳,则反应②的离子方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水的电离平衡曲线如图示,试回答下列问题:
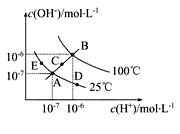
(1)图中五点Kw间的关系是_________。
(2)若从A点到D点,可采用的措施是_________。
A 升温 B 加入少量的盐酸 C 加入少量的NH4Cl
(3)B对应温度下,将pH=11的苛性钠溶液V1 L与0.05mol/L的稀硫酸V2L 混合(设混合前后溶液的体积不变),所得混合溶液的pH=2,则 V1∶V2=________________。
(4)常温下,将V mL、0.1000mol·L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中充分反应。请回答下列问题(忽略溶液体积的变化)
①如果溶液pH=7,此时V的取值___________20.00(填“>”“<”或“=”)。而溶液 中c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为___________。
②如果V=40.00,则此时溶液中c(OH-)-c(H+)-c(CH3COOH)=________mol·L-1(填数据)
(5)在0.10 mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=____________mol·L-1。(Ksp[Cu(OH)2]=2.2×10-20)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com