
【题目】常温下,在某200mL的稀硫酸和稀硝酸的混合溶液中逐量地加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。(设硝酸只被还原为NO气体,Fe的相对原子质量为56)。下列有关分析错误的是
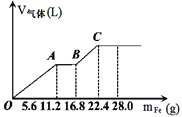
A.原混合酸中NO3-的物质的量为0.2mol
B.原混合酸中H2SO4物质的量浓度为2mol/L
C.OA段与BC段反应中电子转移的物质的量之比为2:1
D.取20mL原混合酸加水稀释至1L后溶液的pH=1
【答案】C
【解析】
硝酸是氧化性酸,因此首先与铁反应,即OA段表示铁与硝酸反应生成硝酸铁、NO和水,离子方程式为Fe+4H++NO3-=Fe3++2H2O+NO↑,当NO3-完全被还原后继续介入铁粉,铁离子开始氧化铁粉,即AB段的离子方程式为Fe+2Fe3+=3Fe2+,最后加入铁粉,氢离子与铁发生置换反应生成氢气,即BC段反应的离子方程式为Fe+2H+=F2+H2↑,据此可以判断。
A、点A时溶液中的NO3-尾气被还原为NO,此时消耗铁的质量是11.2g,物质的量为11.2g÷56g/mol=0.2mol,则根据方程式可知消耗NO3-的物质的量是0.2mol,所以原混合酸中NO3-的物质的量为0.2mol,故A正确;
B、最终消耗铁的质量是22.4g,物质的量为22.4g÷56g/mol=0.4mol,因此最终生成硫酸亚铁的物质的量是0.4mol,则根据原子守恒可知,硫酸的物质的量是0.4mol,则硫酸的浓度为0.4mol÷0.2L=2.0mol/L,B正确;
C、OA段消耗0.2mol铁,转移电子0.2mol×3=0.6mol,BC阶段消耗铁的质量是22.4g-16.8g=5.6g,物质的量是0.1mol,则转移电子0.1mol×2=0.2mol,所以OA段与BC段反应中电子转移的物质的量之比为3:1,故C错误;
D、原混合酸硝酸和硫酸的物质的量分别是0.2mol和0.4mol,其中氢离子的物质的量是0.2mol+0.4mol×2=1.0mol,则氢离子的浓度为1.0mol/L÷0.2L=5mol/L,所以取20mL原混合酸加水稀释至1L后溶液中氢离子的浓度为![]() ×5mol/L=0.1mol/L,则溶液的pH=1,故D正确;
×5mol/L=0.1mol/L,则溶液的pH=1,故D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】在一体积固定的密闭容器中,某化学反应2A(g)![]() B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如表:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如表:
实验序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800 | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800 | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)实验1中,在10~20min内,用A表示的该反应的平均速率为________mol·L-1·min-1。
(2)实验2中c2=________,反应经20min就达到平衡,可推测实验2中还隐含的条件是________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3______(填“>”“<”或“=”,下同)v1,且c3_____1.0。
(4)请根据以上实验指出要加快该反应速率可采取的方法:________。(至少列举2种方法)
查看答案和解析>>
科目:高中化学 来源: 题型:
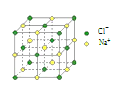
【题目】用 NA 表示阿伏加德罗常数,下列说法中正确的是
A.1 L 1 mol·L-1 的醋酸溶液中 H+的数目为 NA
B.4 mol NaCl 晶体中含有右图所示的结构单元的数目为 NA
C.71 g Cl2 通入水中,HClO、Cl-两种粒子数目总和为 2NA
D.标准状况下,22.4 L CHCl3 和 CCl4 的混合物所含有分子数目为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在恒容密闭容器中进行反应3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g)不能表示上述反应达到化学平衡状态的是( )
Si3N4(s)+12HCl(g)不能表示上述反应达到化学平衡状态的是( )
A.v逆(N2)=3v正(H2)
B.N2和HCl物质的量之比保持不变
C.混合气体密度保持不变
D.每消耗3molSiCl4(g)的同时消耗1molSi3N4(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CPAE是蜂胶的主要活性成分,由咖啡酸合成CPAE的路线如下:
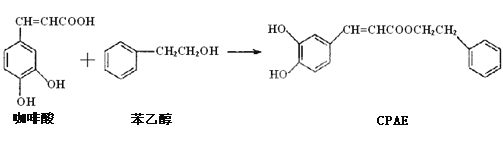 +H2O
+H2O
下列关于上述所列有机物的说法中正确的是( )
A.咖啡酸、CPAE及苯乙醇都能发生取代、加成、氧化及消去反应
B.用FeCl3溶液可以来检测上述反应中是否有CPAE生成
C.苯乙醇是最简单的芳香醇,与邻乙基苯酚互为同系物关系
D.1mol的咖啡酸最多可与4mol Br2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列给定条件的溶液中,一定能大量共存的离子组是( )
A.使pH试纸显深蓝色的溶液:Ca2+、NH4+、HCO3-、Cl-
B.室温下,![]() =0.1mol/L的溶液:Na+、K+、SiO32-、NO3-
=0.1mol/L的溶液:Na+、K+、SiO32-、NO3-
C.含FeCl3的溶液:K+、Na+、SO42-、CO32-
D.能与金属铝反应放出氢气的溶液:Mg2+、Na+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气经压缩升温后进入10m3的甲醇合成塔中,在催化剂的作用下进行甲醇合成,主要反应是:2H2(g) + CO(g)![]() CH3OH(g)+181.6kJ。已知:某温度下(设温度为T1℃)此反应的平衡常数为160。
CH3OH(g)+181.6kJ。已知:某温度下(设温度为T1℃)此反应的平衡常数为160。
(1)此温度下,在密闭容器中加入一定量的CO和H2,反应到某时刻测得各组分的浓度如表:
物质 | H2 | CO | CH3OH |
浓度/(mol/L) | 0.2 | 0.1 | 0.4 |
比较此时正、逆反应速率的大小:v正_______v逆 (填“>”、“<”或“=”);若加入与上述同样多的CO和H2,在T2℃条件下反应,10 min后达平衡时c(H2)=0.4mol/L,则该时间内反应速率v(CH3OH)=_______ mol/(L·min);
(2)在一定条件的密闭恒容的容器中,下列式子或文字描述能表示上述反应达到化学平衡状态的是_______(选填序号);
a.2v逆(CO) = v正(H2)
b.c(CO): c(H2):c(CH3OH) =1:2:1
c.混合气体的平均式量保持不变
d.混合气体的密度保持不变
(3)上述反应达到平衡后,下列说法正确的是_______(选填序号);
a.其他条件不变,增大压强,平衡常数K﹤160
b.其他条件不变,温度升高,平衡常数K会减小
c.其他条件不变,若同比例地增加CO和H2的量平衡不会发生移动
d.其他条件不变,增大甲醇的物质的量,正反应速率也会随之逐渐增大
(4)寻找合适的催化剂来改善上述合成甲醇的条件一直是研究课题。现分别对X、Y、Z三种催化剂进行如下实验(其他条件均相同):
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂并简述理由____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大苏打(Na2S2O3·5H2O)、苏打、小苏打被称为“苏氏三兄弟”,它们在生活、生产中有广泛应用。
(1)工业上制备苏打是先制备小苏打,写出我国伟大化学家侯德榜提出的制备小苏打的化学方程式___,操作时,往饱和食盐水中先通入气体,先制备小苏打的原因是___。
(2)Na2S2O3标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高,用离子方程式表示其原因__。
(3)工业上,常用纯碱和盐酸除去锅炉中硫酸钙。先用饱和纯碱溶液浸泡锅垢,然后用盐酸清洗。“浸泡”的目的是__。
(4)工业上,将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。写出该反应的化学方程式__。Na2S溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的化学式为__。
(5)在密闭容器中投入一定量的Na2O2和NaHCO3,在300℃下充分反应。若残留固体为纯净物,则起始时![]() 满足的条件是__。
满足的条件是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(A)=0.5 mol·L-1·s-1B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1D.v(D)=1 mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com