
【题目】铋(Bi)及其化合物广泛应用于电子、医药等领域。一种以含铋矿石辉铋矿(主要成分为Bi2S3,含少量杂质PbO2等)为原料,采用湿法冶金制备铋单质的工艺流程如下:
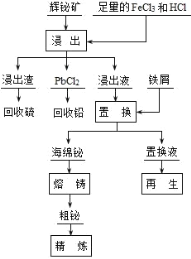
已知:PbCl2是一种难溶于冷水,易溶于热水的白色固体。 回答下列问题:
(1)铋(Bi)位于ⅤA族,铋的氢化物的热稳定性______氨气(填“大于”或“小于”)。
(2)“浸出”时,为了提高浸出速率,可采用的措施有______(任写一条)
(3)加热浸出时,PbO2 生成 PbCl2 和一种气体,此反应的化学方程式为______, 从产物中分离回收 PbCl2 的步骤是______、洗涤、干燥。从保护环境和原料循环利 用的角度,请指出上述工艺流程中可以采取的措施为______。
(4)电解精炼粗铋时必须补充含 Bi3+浓度高的电解液。可用粗铋、铅条作为两个电极,铅条外用素烧 的陶瓷坩埚作隔膜(Bi3+不能透过,H+能透过),电解液开始时为盐酸和食盐的混合液。则粗铋为电解池的 ______极,电解总反应为______。
(5)25℃时,向浓度均为 0.02mol·L-1 的 Cu2+、Bi3+的混合溶液中滴加 Na2S 溶液(设溶液体积增加 1倍),使 Cu2+恰好沉淀完全即溶液中 c(Cu2+)=1×10-5 mol·L-1,此时是否有 Bi2S3 沉淀生成______(列式计算说明)。(已知:25℃时,Ksp(CuS)=6.0×10-36、Ksp(Bi2S3)=1.8×10-99)
【答案】小于 粉碎矿石、搅拌、适当提高浸取液温度 、适当提高溶液浓度等 PbO2 +4HCl![]() PbCl2 + Cl2↑+2H2O 冷却、过滤 “浸出”时生成的氯气,通入置换液中生成三氯化铁循环利用 阳
PbCl2 + Cl2↑+2H2O 冷却、过滤 “浸出”时生成的氯气,通入置换液中生成三氯化铁循环利用 阳 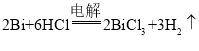 Qc(Bi2S3)=(0.01)2×(6.0×10-36÷1×10-5)3=2.16×10-95> Ksp(Bi2S3)= 1.8×10-99,故有Bi2S3沉淀生成
Qc(Bi2S3)=(0.01)2×(6.0×10-36÷1×10-5)3=2.16×10-95> Ksp(Bi2S3)= 1.8×10-99,故有Bi2S3沉淀生成
【解析】
辉铋矿(主要成分是Bi2S3、还含PbO2杂质)制备铋酸钠,辉铋矿加入氯化铁溶液和盐酸溶解后过滤,氯化铁氧化硫离子为硫单质:Bi2S3+6FeCl3=2BiCl3+6FeCl2+3S,盐酸是防止FeCl3及BiCl3水解生成不溶性沉淀,所以得到滤渣为S,滤液中含有Bi3+,H+,Pb2+,滤液冷却结晶可以得到PbCl2,然后回收铅;再次过滤得到的滤液中加入铁粉过滤得到海绵铋,置换液主要是氯化亚铁;对海绵铋进行熔铸、精炼得到金属铋;置换液中再通入氯气得到氯化铁溶液可以循环使用。
(1)同周期,从上往下,氢化物的稳定性逐渐降低,故铋的氢化物的热稳定性小于氨气;
(2)为了提高浸出率,可采取的措施有将矿石粉粹、搅拌,以增大接触面接,也可适当增大氯化铁溶液的浓度、适当升高温度等;
(3)浸出时,PbO2 生成PbCl2,Pb的化合价降低,则浸出液中HCl化合价升高生成Cl2,化学方程式为PbO2+4HCl=PbCl2+Cl2↑+2H2O;由于PbCl2难溶于冷水,易溶于热水,可对滤液进行冷却结晶然后过滤分离回收PbCl2;置换液为FeCl2,可将浸出时产生的Cl2通入置换液中,使FeCl2转化为FeCl3循环利用,同时防止污染环境;
(4)电解时金属铋需要被氧化生成Bi3+,电极池中阳极得电子发生氧化反应,所以粗铋为电解池的阳极;阴极得电子发生还原反应,根据电解质溶液中的离子种类可知阴极应是氢离子得电子生成氢气,所以电解总反应为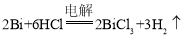 ;
;
(5)Cu2+恰好沉淀完全即溶液中c(Cu2+)=1×10-5molL-1,则此时溶液中c(S2-)=![]() ,此时Qc(Bi2S3)=0.012×(
,此时Qc(Bi2S3)=0.012×(![]() )3=2.16×10-95>Ksp(Bi2S3)=1.8×-99,故有Bi2S3沉淀生成。
)3=2.16×10-95>Ksp(Bi2S3)=1.8×-99,故有Bi2S3沉淀生成。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】在下列给定条件的溶液中,一定能大量共存的离子组是( )
A.使pH试纸显深蓝色的溶液:Ca2+、NH4+、HCO3-、Cl-
B.室温下,![]() =0.1mol/L的溶液:Na+、K+、SiO32-、NO3-
=0.1mol/L的溶液:Na+、K+、SiO32-、NO3-
C.含FeCl3的溶液:K+、Na+、SO42-、CO32-
D.能与金属铝反应放出氢气的溶液:Mg2+、Na+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是一个巨大的资源宝库,海水开发利用的部分过程如图所示。下列有关说法不正确的是( )
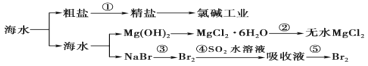
A.①粗盐制精盐除采用过滤泥沙外,还必须除去 Ca2+、Mg2+、SO42-等杂质
B.工业生产中常选用石灰乳作为 Mg2+的沉淀剂,并对沉淀进行洗涤
C.第②步的反应是将 MgCl26H2O 晶体在空气中直接加热脱去结晶水得无水 MgCl2
D.第③步到第⑤步空气吹出法提取海水中溴通常使用 SO2 作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用如图装置(部分固定装置略去)制备氮化钙(Ca3N2),并探究其实验式。
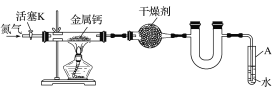
按图连接好实验装置。检查装置的气密性,方法是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(A)=0.5 mol·L-1·s-1B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1D.v(D)=1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)连二次硝酸中氮元素的化合价为_____________________。
(2)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。
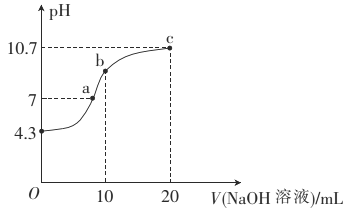
①写出H2N2O2在水溶液中的电离方程式:______________。
②b点时溶液中c(H2N2O2)_____(填“>”、“<”或 “=”,下同)c(N2O22-)。
③a点时溶液中c(Na+)____c(HN2O2-)+c(N2O22-)。
(3)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中![]() =______。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
=______。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示法正确的是( )
A. 由“C(s,石墨)→C(s,金刚石)△H=+119kJ·mol-1”可知金刚石比石墨稳定
B. 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O (1) △H=-285.8kJ·mol-1
C. 在101kPa时,1mol碳燃烧所放出的热量为碳的燃烧热
D. 等量的磷蒸气和磷固体分别完全燃烧,前者放出的热量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.由“C(石墨)=C(金刚石) ΔH= +1.9kJ·mol-1”可知,金刚石比石墨稳定
B.500℃、30M Pa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH= -38.6kJ·mol-1
2NH3(g) ΔH= -38.6kJ·mol-1
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH= -57.3kJ·mol-1,若将含1mol CH3COOH与含1mol NaOH的溶液混合,放出的热量小于57.3kJ
D.X(g)+Y(g)![]() Z(g) ΔH >0,恒温恒容条件下达到平衡后加入X,上述反应ΔH增大
Z(g) ΔH >0,恒温恒容条件下达到平衡后加入X,上述反应ΔH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2) = 5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3) = 3v正(H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com