
【题目】下列说法正确的是( )
A.由“C(石墨)=C(金刚石) ΔH= +1.9kJ·mol-1”可知,金刚石比石墨稳定
B.500℃、30M Pa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH= -38.6kJ·mol-1
2NH3(g) ΔH= -38.6kJ·mol-1
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH= -57.3kJ·mol-1,若将含1mol CH3COOH与含1mol NaOH的溶液混合,放出的热量小于57.3kJ
D.X(g)+Y(g)![]() Z(g) ΔH >0,恒温恒容条件下达到平衡后加入X,上述反应ΔH增大
Z(g) ΔH >0,恒温恒容条件下达到平衡后加入X,上述反应ΔH增大
【答案】C
【解析】
A.ΔH=+1.9kJ/mol,为吸热反应,则石墨的能量低,则石墨比金刚石稳定,故A错误;
B.0.5mol N2(g)和1.5mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,则1molN2(g)完全反应放出热量大于38.6kJ,可知N2(g)+3H2(g)2NH3(g) ΔH<38.6kJmol1,故B错误;
C.醋酸是弱酸,在水溶液中没有完全电离,醋酸电离时吸热,所以1molCH3COOH与1mol NaOH溶液反应放热少于强酸,故C正确;
D.一定条件下,反应热与平衡移动无关,与化学计量数与物质的状态有关,故D错误;
故答案选C。


科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g))![]() 2SO3(g)反应过程的能量变化如图所示,已知1molSO2(g)被氧化为1molSO3(g)的ΔH=-akJ/mol(a﹥0)。回答下列问题:
2SO3(g)反应过程的能量变化如图所示,已知1molSO2(g)被氧化为1molSO3(g)的ΔH=-akJ/mol(a﹥0)。回答下列问题:
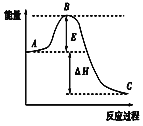
(1)图中A表示:__,E的大小对该反应的反应热ΔH__(填“是”或“否”)有影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点__(填“升高”或“降低”),理由是__。
(2)图中ΔH=__kJ/mol。
(3)在一定温度下,将2molSO2和1molO2放在一密闭容器中,在催化剂作用下充分反应。测得反应放出的热量__(填“等于”、“大于”或“小于”)2akJ。
(4)V2O5的催化循环机理可能为:V2O5氧化SO2时,自己被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:
①__;②4VO2+O2=2V2O5
(5)已知固态单质硫的燃烧热为bkJ/mol,计算由S(s)生成3molSO3(g)的ΔH=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋(Bi)及其化合物广泛应用于电子、医药等领域。一种以含铋矿石辉铋矿(主要成分为Bi2S3,含少量杂质PbO2等)为原料,采用湿法冶金制备铋单质的工艺流程如下:
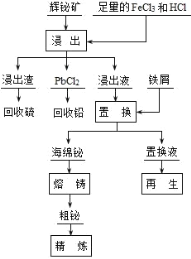
已知:PbCl2是一种难溶于冷水,易溶于热水的白色固体。 回答下列问题:
(1)铋(Bi)位于ⅤA族,铋的氢化物的热稳定性______氨气(填“大于”或“小于”)。
(2)“浸出”时,为了提高浸出速率,可采用的措施有______(任写一条)
(3)加热浸出时,PbO2 生成 PbCl2 和一种气体,此反应的化学方程式为______, 从产物中分离回收 PbCl2 的步骤是______、洗涤、干燥。从保护环境和原料循环利 用的角度,请指出上述工艺流程中可以采取的措施为______。
(4)电解精炼粗铋时必须补充含 Bi3+浓度高的电解液。可用粗铋、铅条作为两个电极,铅条外用素烧 的陶瓷坩埚作隔膜(Bi3+不能透过,H+能透过),电解液开始时为盐酸和食盐的混合液。则粗铋为电解池的 ______极,电解总反应为______。
(5)25℃时,向浓度均为 0.02mol·L-1 的 Cu2+、Bi3+的混合溶液中滴加 Na2S 溶液(设溶液体积增加 1倍),使 Cu2+恰好沉淀完全即溶液中 c(Cu2+)=1×10-5 mol·L-1,此时是否有 Bi2S3 沉淀生成______(列式计算说明)。(已知:25℃时,Ksp(CuS)=6.0×10-36、Ksp(Bi2S3)=1.8×10-99)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定温度下,在容积为V L的密闭容器中进行反应:aN(g)![]() bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:

①此反应的化学方程式中a :b=__________
②t1到t2时刻,以M的浓度变化表示的平均反应速率为:_________________
③下列叙述中能说明上述反应达到平衡状态的是______________
A.反应中M与N的物质的量之比为1︰1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
(2)如图是某锌锰干电池的基本构造图。
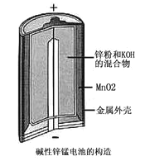
①该干电池的总反应式为2MnO2+Zn+2H2O=2MnO(OH)+ Zn(OH)2,该电池的负极是___________,工作时正极的电极反应式是______________________________。
②关于该电池的使用和性能,下列说法正确的是____________
A.该电池属于蓄电池
B.电池工作时OH-向负极移动
C.该电池的电解质溶液是H2SO4溶液
D.该电池用完后可随意丢弃,不需要回收处理
(3)另一种常用的电池锂电池由于比容量(单位质量电极材料所能转换的电量)特别大而广泛用于心脏起搏器,它的负极材料用金属锂制成,电解质溶液需用非水溶液配制,请用化学方程式表示不能用水溶液的原因_______________________________。
(4)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一氢氧燃料电池,以电极a为正极,电极b为负极,采用氢氧化钠溶液为电解液,则氧气应通入_________极(填序号),电解质溶液的pH将____________(填“变大”,“变小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业中很多重要的原料都是来源于石油化工,回答下列问题
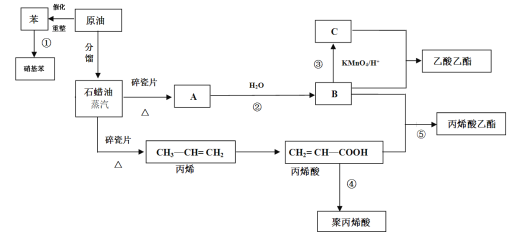
(1)C的结构简式为________。
(2)③④反应的反应类型分别为_____________、___________。
(3)丙烯酸(CH2 = CH — COOH)可能发生的反应有____________(填序号)
A 加成反应 B 取代反应 C 加聚反应 D 中和反应 E 氧化反应
(4)写出下列反应方程式
①反应①的化学方程式__________________________________________________;
②反应②的化学方程式__________________________________________________;
③反应⑤的化学方程式__________________________________________________。
(5)丙烯分子中最多有______个原子共面。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3·H2O![]() NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
①NH4Cl固体;②硫酸;③NaOH固体;④水;⑤加热;⑥加入少量MgCl2固体。
A.①②③⑤B.③⑥C.③D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代膜技术可使某种离子具有单向通过能力,常用于电解池、原电池中。电解NaB(OH)4溶液可制备H3BO3,其工作原理如图。下列叙述错误的是( )
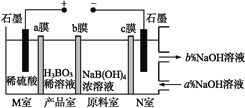
A. M室发生的电极反应式:2H2O-4e-![]() O2↑+4H+
O2↑+4H+
B. N室:a<b
C. 产品室发生的反应是B(OH)4- +H+![]() H3BO3+H2O
H3BO3+H2O
D. 理论上每生成1 mol产品,阴极室可生成标准状况下5.6 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.苯酚与乙醇的官能团都是羟基
B.炔烃的官能团是碳碳双键
C.官能团是反应一类化合物物理性质的原子或原子团
D.饱和一元羧酸的通式为CnH2n+2O2E. 饱和一元羧酸的通式为CnH2n+2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】西瓜膨大剂别名氯吡苯脲,是经过国家批准的植物生长调节剂,实践证明长期使用对人体无害。已知其相关性质如下表所示:
分子式 | C12H10ClN3O |
结构简式 |
|
外观 | 白色结晶粉末 |
熔点 | 170~172℃ |
溶解性 | 易溶于水 |
(1)氯吡苯脲晶体中,氮原子的杂化方式为___。
(2)两种组成均为CoCl3·4NH3的配合物分别呈绿色和紫色。已知绿色的配合物内界结构对称,请在图a和图b中用元素符号标出氯原子的位置___、___。
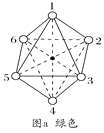
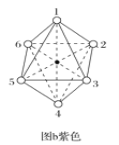
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com