
【题目】2SO2(g)+O2(g))![]() 2SO3(g)反应过程的能量变化如图所示,已知1molSO2(g)被氧化为1molSO3(g)的ΔH=-akJ/mol(a﹥0)。回答下列问题:
2SO3(g)反应过程的能量变化如图所示,已知1molSO2(g)被氧化为1molSO3(g)的ΔH=-akJ/mol(a﹥0)。回答下列问题:
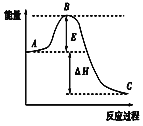
(1)图中A表示:__,E的大小对该反应的反应热ΔH__(填“是”或“否”)有影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点__(填“升高”或“降低”),理由是__。
(2)图中ΔH=__kJ/mol。
(3)在一定温度下,将2molSO2和1molO2放在一密闭容器中,在催化剂作用下充分反应。测得反应放出的热量__(填“等于”、“大于”或“小于”)2akJ。
(4)V2O5的催化循环机理可能为:V2O5氧化SO2时,自己被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:
①__;②4VO2+O2=2V2O5
(5)已知固态单质硫的燃烧热为bkJ/mol,计算由S(s)生成3molSO3(g)的ΔH=___。
【答案】反应物总能量或2molSO2和1molO2的总能量 否 降低 催化剂能降低反应所需的活化能 -2a 小于 V2O5+SO2=2VO2+SO3 -3(a+b)kJ/mol
【解析】
(1)反应2SO2(g)+O2(g)=2SO3(g)为放热反应,则反应物总能量大于生成物总能量,E为活化能,反应热为活化能之差,活化能对反应热无影响,加入催化剂,改变了反应历程,活化能降低;
(2)由1molSO2(g)氧化为1molSO3(g)的ΔH=-98kJ/mol计算2SO2(g)+O2(g)=2SO3(g)ΔH的值;
(3)可逆反应,不会都转化完;
(4)由V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化为V2O5写出反应的化学方程式;
(5)根据盖斯定律计算由S(s)生成3molSO3(g)的ΔH值。
(1)1molSO2(g)氧化为1molSO3(g)的ΔH=-akJ/mol,说明反应2SO2(g)+O2(g)=2SO3(g)为放热反应,则反应物总能量大于生成物总能量,E为活化能,反应热为活化能之差,活化能对反应热无影响,加入催化剂,改变了反应历程,活化能降低,故答案为:反应物总能量;否;降低;催化剂能降低反应所需的活化能;
(2)已知1molSO2(g)氧化为1molSO3(g)的ΔH=-akJ/mol,则2SO2(g)+O2(g)=2SO3(g)ΔH=-2akJ/mol,故答案为:-2a;
(3) 2molSO2和1molO2完全反应,放出热量2akJ,但该反应为可逆反应,不会完全进行,放出热量小于2akJ,故答案为:小于;
(4)V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化为V2O5,相关反应为SO2+V2O5=SO3+2VO2,故答案为:SO2+V2O5=SO3+2VO2;
(5)单质硫的燃烧热为bkJ/mol,热化学方程式为:①S(s)+O2(g)=SO2(g)ΔH=-bkJ/mol,②2SO2(g)+O2(g)=2SO3(g)ΔH=-2akJ/mol,依据盖斯定律①×2+②得到2S(s)+3O2(g)=2SO3(g)ΔH=-bkJ/mol×2+(-2akJ/mol)=-2(a+b)kJ/mol,则由S(s)生成3molSO3(g)的ΔH=-2(a+b)kJ/mol×3/2=-3(a+b)kJ/mol,故答案为:-3(a+b)kJ/mol。


科目:高中化学 来源: 题型:
【题目】2mol金属钠和1mol氯气反应的能量关系如图所示,下列说法不正确的是( )
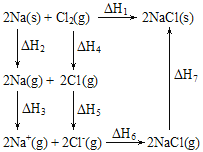
A.ΔH1=ΔH2+ΔH3+ΔH4+ΔH5+ΔH6+ΔH7
B.ΔH4的值数值上和Cl-Cl共价键的键能相等
C.ΔH7<0,且该过程形成了分子间作用力
D.ΔH5<0,在相同条件下,2Br(g)的ΔH5′>ΔH5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列给定条件的溶液中,一定能大量共存的离子组是( )
A.使pH试纸显深蓝色的溶液:Ca2+、NH4+、HCO3-、Cl-
B.室温下,![]() =0.1mol/L的溶液:Na+、K+、SiO32-、NO3-
=0.1mol/L的溶液:Na+、K+、SiO32-、NO3-
C.含FeCl3的溶液:K+、Na+、SO42-、CO32-
D.能与金属铝反应放出氢气的溶液:Mg2+、Na+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
①Al2O3![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3
Al(OH)3
②S![]() SO3
SO3![]() H2SO4
H2SO4
③饱和NaCl(aq)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
④Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() 无水FeCl3
无水FeCl3
⑤MgCl2(aq) ![]() Mg(OH)2
Mg(OH)2 ![]() MgO
MgO
A.①②③B.②③④C.①③⑤D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大苏打(Na2S2O3·5H2O)、苏打、小苏打被称为“苏氏三兄弟”,它们在生活、生产中有广泛应用。
(1)工业上制备苏打是先制备小苏打,写出我国伟大化学家侯德榜提出的制备小苏打的化学方程式___,操作时,往饱和食盐水中先通入气体,先制备小苏打的原因是___。
(2)Na2S2O3标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高,用离子方程式表示其原因__。
(3)工业上,常用纯碱和盐酸除去锅炉中硫酸钙。先用饱和纯碱溶液浸泡锅垢,然后用盐酸清洗。“浸泡”的目的是__。
(4)工业上,将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。写出该反应的化学方程式__。Na2S溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的化学式为__。
(5)在密闭容器中投入一定量的Na2O2和NaHCO3,在300℃下充分反应。若残留固体为纯净物,则起始时![]() 满足的条件是__。
满足的条件是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kPa下,稀强酸与稀强碱溶液反应中和热为57.3kJ/mol。
(1)写出表示稀H2SO4与稀烧碱溶液反应的中和热的热化学方程式:___。
(2)学生甲用50mL0.25mol/L硫酸与50mL0.55mol/L烧碱溶液测定中和热装置如图。
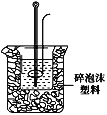
①实验时所需的玻璃仪器除烧杯、量筒外还需:__。
②该装置中有一处错误是:___。如果用该错误装置测定,测得的中和热ΔH会___(填“偏大、偏小、无影响”)。
③如果用60mL0.25mol/L硫酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所求中和热___(填“相等、不相等”)。
④若反应前溶液以及中和后的混合液的密度均设为1g/cm3,混合前酸与碱的温度均为t1,混合后溶液的温度为t2,比热容为4.18J/(g·℃),则中和热ΔH=___。
(3)学生乙用2mol/L的硫酸来测定与锌粒和锌粉反应的快慢,设计如图装置:
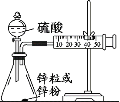
该生两次实验测定时间均设定为10min,则他还要测定的另一个数据是:___。
②若要减小产生H2的速率而又不影响产生H2的总量,应向硫酸中加入___(填字母)
a.Na2CO3溶液 b.K2SO4溶液 c.NaNO3溶液 d.水 e.CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是一个巨大的资源宝库,海水开发利用的部分过程如图所示。下列有关说法不正确的是( )
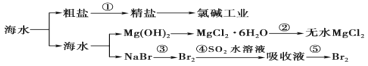
A.①粗盐制精盐除采用过滤泥沙外,还必须除去 Ca2+、Mg2+、SO42-等杂质
B.工业生产中常选用石灰乳作为 Mg2+的沉淀剂,并对沉淀进行洗涤
C.第②步的反应是将 MgCl26H2O 晶体在空气中直接加热脱去结晶水得无水 MgCl2
D.第③步到第⑤步空气吹出法提取海水中溴通常使用 SO2 作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用如图装置(部分固定装置略去)制备氮化钙(Ca3N2),并探究其实验式。
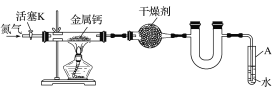
按图连接好实验装置。检查装置的气密性,方法是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.由“C(石墨)=C(金刚石) ΔH= +1.9kJ·mol-1”可知,金刚石比石墨稳定
B.500℃、30M Pa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH= -38.6kJ·mol-1
2NH3(g) ΔH= -38.6kJ·mol-1
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH= -57.3kJ·mol-1,若将含1mol CH3COOH与含1mol NaOH的溶液混合,放出的热量小于57.3kJ
D.X(g)+Y(g)![]() Z(g) ΔH >0,恒温恒容条件下达到平衡后加入X,上述反应ΔH增大
Z(g) ΔH >0,恒温恒容条件下达到平衡后加入X,上述反应ΔH增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com