
【题目】如图是元素周期表的一部分,其中每个数字编号代表对应的一种元素.

请按要求回答下列问题:
(1)画出元素②的原子结构示意图_____________________.
(2)属于稀有气体的元素编号是________________,可作半导体材料的元素编号是_________________.
(3)③、⑦两种元素相比较,非金属性强的是__________________(填元素符号).
(4)元素④的单质与元素⑤的单质反应可生成两种化合物,化学式分别是__________,______.
(5)元素③和元素⑧的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式:_________________________________.
【答案】  ⑨ ⑦ N Na2O Na2O2 NH3+HCl=NH4Cl
⑨ ⑦ N Na2O Na2O2 NH3+HCl=NH4Cl
【解析】根据元素在周期表中的位置知,①~⑨分别是H、C、N、O、Na、Al、Si、Cl、Ar元素,则
(1)元素②的原子核外有2个电子层、最外层电子数是4,其原子结构示意图为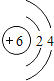 ;(2)Ar属于稀有气体,其编号是⑨;可作半导体材料的元素是Si,其编号是⑦;(3)同一周期元素,元素的非金属性随着原子序数的增大而增强,同一主族,元素的非金属性随着原子序数的增大而减弱,N元素的非金属性大于P元素,Si元素的非金属性小于P元素,所以N元素的非金属性大于Si元素;(4)元素④的单质与元素⑤的单质反应可生成两种化合物,分别为氧化钠和过氧化钠,化学式分别为:Na2O、Na2O2;(5)元素③和元素⑧的氢化物分别是氨气和氯化氢,二者均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,白烟是氯化铵固体,反应方程式为NH3+HCl=NH4Cl。
;(2)Ar属于稀有气体,其编号是⑨;可作半导体材料的元素是Si,其编号是⑦;(3)同一周期元素,元素的非金属性随着原子序数的增大而增强,同一主族,元素的非金属性随着原子序数的增大而减弱,N元素的非金属性大于P元素,Si元素的非金属性小于P元素,所以N元素的非金属性大于Si元素;(4)元素④的单质与元素⑤的单质反应可生成两种化合物,分别为氧化钠和过氧化钠,化学式分别为:Na2O、Na2O2;(5)元素③和元素⑧的氢化物分别是氨气和氯化氢,二者均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,白烟是氯化铵固体,反应方程式为NH3+HCl=NH4Cl。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-=CaCO3+H2O
B. 氯化铵与氢氧化钠两种浓溶液混合加热:NH4++OH-=H2O+NH3↑
C. 氢氧化镁与稀硫酸反应:H++OH-=H2O
D. 单质铜与稀硝酸反应:Cu+2H++2NO3-=Cu2++2NO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)CH3COOH是最常见的有机弱酸。
①CH3COOH的电离方程式为_____________。
②CH3COONa溶液呈碱性,原因是__________(填“CH3COO-”或“Na+”)水解引起的。
③ 在CH3COONa溶液中,c(Na+)_______c(CH3COO-)、(填“>”“=”或“<”)
(2)已知:反应C(s)+H2O(g)![]() CO(g)+H2(g)的△H=131.3kJ/mol
CO(g)+H2(g)的△H=131.3kJ/mol
① 该反应是反应__________(填“吸热”或“放热”)。
② 若反应消耗24gC(s),则反应的热效应为__________。
(3)在一定温度下,将CO(g)和H2O(g)各0.16 mol 通入容积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
t/min | 2 | 4 | 7 | 9 |
n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
① 2 min 内,vCO=__________。
② 该温度下,此反应的平衡常数表达式K=_________。
③ 其他条件不变,再充入0.1molCO和0.1molH2O(g),达到平衡时CO 的休积分数_____(填“增大”、“减小”或“不变”)。
(4)下图为直流电源电解CuSO4溶液的装置,C1和C2都为石墨电极,请回答下列问题:
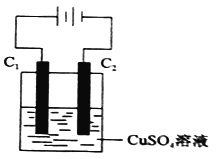
① C1作_________(填“阳极”或”阴极”)。
② C2极电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 0.1 mol·L-1的醋酸加水稀释,c(CH3COOH)/c(CH3COO—)减小
B. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大
C. 体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量)后者用时少
D. 常温下pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合,溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下面是石蜡油在炽热碎瓷片的作用下产生乙烯并检验其性质的实验,回答问题。

①A中碎瓷片的作用是___________。
②B中反应类型是______,C中实验现是____________________________。
(2)在一定条件下,乙烷和乙烯都能制得一氯乙烷(CH3CH2Cl),据此回答问题:
①方法一:由乙烷制备一氯乙烷的的化学方程式为:____________________。
方法二:由乙烯制备一氯乙烷的反应类型属于_______________。
比较以上两种方法,方法______较好,其原是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质既能跟硫酸反应,又能跟氢氧化钠溶液反应的是
① NaHCO3 ② Al2O3 ③ Al(OH)3 ④ Al
A.①②③④ B.①和③ C.③和④ D.①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
(1)打开K2 ,合并K1 ,若所盛溶液为CuSO4溶液:则A为 极,A极的电极反应式为 。若所盛溶液为KCl溶液:则B极的电极反应式为 , K+移向 极(填A、B)

(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则:①A电极附近可观察到的现象是 。
②B电极上的电极反应式为 ,总反应化学方程式是 。
③反应一段时间后打开K2 , 若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(标准状况)为11.2mL, 将溶液充分混合,溶液的pH约为 。若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的 。
(3)如要用电解方法精炼粗铜,打开K1,合并K2,电解液选用CuSO4溶液,则A电极的材料应换成是 ,电极反应式是 ,反应一段时间后电解质溶液中Cu2+浓度 (填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有K+、Na+、Fe3+、Fe2+、SO42-、CO32-、I-、Cl-中的一种或多种,进行如图所示的实验,下列说法正确的是 ( )
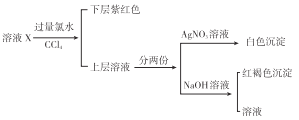
A. 溶液X中有Fe3+、SO42-
B. 溶液X中有Fe2+、I-可能有SO42-、Cl-
C. 溶液X中有I-、Cl-,无CO32-
D. 溶液X中有I-,Fe2+和Fe3+两种离子中至少有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不饱和酯类化合物在药物、涂料等领域应用广泛。(6分,每空1分)

Ⅰ
(1)下列化合物Ⅰ的说法,正确的是 。
A.遇FeCl3溶液可能显紫色
B.可发生酯化反应和银镜反应
C.能与溴发生取代和加成反应
D.1 mol化合物Ⅰ最多能与2 mol NaOH反应
(2)反应①是一种由烯烃直接制备不饱和酯的新方法:

化合物Ⅱ的分子式为 ,1 mol化合物Ⅱ能与 mol H2恰好完全反应生成饱和烃类化合物。
(3)化合物Ⅱ可由芳香族化合物Ⅲ或Ⅳ分别通过消去反应获得,但只有Ⅲ能与Na反应产生H2,Ⅲ的结构简式为 (写1种);由Ⅳ生成Ⅱ的反应条件为 。
(4)聚合物![]() 可用于制备涂料,其单体结构简式为________________。
可用于制备涂料,其单体结构简式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com