
【题目】观察下表模型并结合有关信息,判断下列说法中不正确的是( )
B12结构单元 | SF6分子 | S8分子 | HCN | |
结构模型示意图 |
|
|
|
|
备注 | 熔点1873 K | — | 易溶于CS2 | — |
A.单质硼属于原子晶体,每个B12结构单元中含有30个B—B键和20个正三角形
B.SF6是由极性键构成的非极性分子
C.固态硫S8属于原子晶体
D.HCN的结构式为H—C≡N
科目:高中化学 来源: 题型:
【题目】已知反应:2NO(g)+Br2(g)![]() 2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
①NO(g)+Br2(g)![]() NOBr2(g) 快 ②NO(g)+NOBr2(g)
NOBr2(g) 快 ②NO(g)+NOBr2(g)![]() 2NOBr(g) 慢
2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A. 该反应的速率主要取决于①的快慢
B. NOBr2是该反应的催化剂
C. 正反应的活化能比逆反应的活化能小a kJ·mol-1
D. 增大Br2(g)浓度能增大活化分子百分数, 加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中 使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F是无色无味的气体,H是白色沉淀。
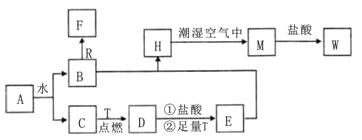
(1)物质A的化学式为 ________,F化学式为 ________;
(2)B和R在溶液中反应生成F的离子方程式为__________________________;
(3)H在潮湿空气中变成M的实验现象是________,化学方程式为______________;
(4)A和水反应生成B和C的化学方程式为__________________________
(5)印刷行业刻制印刷电路板(含有铜箔)时,要用W溶液中作为“腐蚀液”,写出该反应的离子方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在自然环境中,一次性使用的聚苯乙烯材料带来的“白色污染”甚为突出,这种材料难以分解,处理麻烦,最近研制出一种新型的材料能代替聚苯乙烯,它是由乳酸缩聚而生成的,这种材料可在乳酸菌作用下降解。下列关于聚乳酸(结构简式为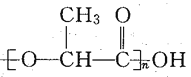 )的说法正确的是
)的说法正确的是
A.聚乳酸是一种纯净物
B.其聚合方式与苯乙烯相似
C.其单体为 CH3─CH2─COOH
D.聚乳酸是一种线型高分子材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(固)+nB(气)![]() pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
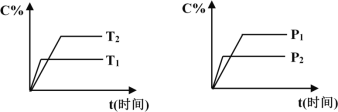
A. 达到平衡后,使用催化剂,C%将增大
B. 达到平衡后,若升高温度、化学平衡向逆反应方向移动
C. 方程式中n>p+q
D. 达到平衡后,增加A的量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在![]() 时,在浓度为
时,在浓度为![]() 的
的![]() 、
、![]() 、
、![]() 的溶液中,已知醋酸的电离常数约等于一水合氨的电离常数,下列判断正确的是
的溶液中,已知醋酸的电离常数约等于一水合氨的电离常数,下列判断正确的是![]()
A.由水电离出的![]() 最大的是
最大的是![]()
B.三种溶液的pH值最小的![]()
C.三种溶液中![]() 最大的是
最大的是![]()
D.三种溶液中只有![]() 显碱性
显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Ni、Si、P等元素)制备,回答下面问题:
(1)钴元素在元素周期表中的位置____。![]() 与硫元素位于同一主族,其价层电子排布式是___。
与硫元素位于同一主族,其价层电子排布式是___。
(2)MnSO4中阴离子的空间构型是____中心原子的杂化类型______。
(3)比较H2S ______H2Se热稳定性:(填“>”“<”)判断依据是______;比较沸点:N2H4 _____P2H4 (填“>”“<”),判断依据是______。
(4) FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子(FeCl3)2存在,画出其结构并标出配位键__________。
(5)MnO具有NaCl型结构(如图),其中阳离子采用面心立方最密堆积方式,设其晶胞参数为apm,则r(Mn2+)为______pm晶胞密度是_____g/cm3(用含a的表达式表示)
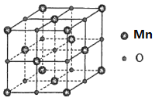
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
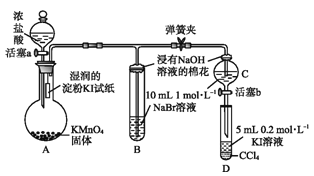
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕色时,关闭活塞a。
Ⅳ………
(1)A中产生黄绿色气体,其电子式是________。
(2)验证氯气的氧化性强于碘的实验现象是_______。
(3)B中溶液发生反应的离子方程式是_______。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是___________。
(5)过程Ⅲ实验的目的是__________。
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下_________,得电子能离逐渐减弱。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为-24.2℃,易溶于乙醇和丙醇等有机溶剂。
Ⅰ.实验室制取CH3Cl的原理是CH3OH+HCl(浓)![]() CH3Cl+H2O。
CH3Cl+H2O。
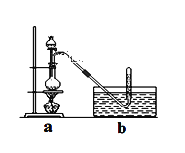
具体步骤如下:①干燥ZnCl2晶体;②称取24g研细的无水ZnCl2和量取20mL浓盐酸放入圆底烧瓶,同时量取一定量的甲醇放入分液漏斗中;
③将分液漏斗里的甲醇逐滴滴入烧瓶中并加热,待ZnCl2完全溶解后有CH3Cl气体逸出,可用排水法收集请回答:
(1)实验室干燥ZnCl2晶体制得无水ZnCl2的方法是________________;
(2)反应过程中滴入烧瓶中甲醇的体积比盐酸少(甲醇与浓盐酸的物质的量浓度接近)其理由是__________;
Ⅱ.据某资料记载,CH4分子中的一个H原子被Cl原子取代后,其稳定性受到影响,可被强氧化剂酸性高锰酸钾氧化,现有四只洗气瓶分别盛有以下试剂:A.1.5%KMnO4(H+)溶液;B.蒸馏水;C.5%Na2SO3溶液;D.98%H2SO4。
(1)为证实这一理论的可靠性,请从上面选择最恰当的洗气瓶,将a装置生成的气体依次通过洗气瓶____(填洗气瓶编号),如果观察到_________则证实上述资料的正确性。
(2)写出洗气瓶中发生反应的离子方程式(C元素的氧化产物为CO2):______;
(3)如果CH3Cl是大气的污染物,上述洗气瓶之后还应接一只盛______的洗气瓶。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com