
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
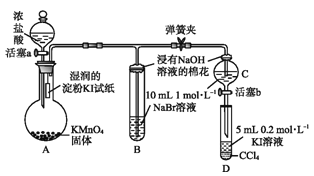
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕色时,关闭活塞a。
Ⅳ………
(1)A中产生黄绿色气体,其电子式是________。
(2)验证氯气的氧化性强于碘的实验现象是_______。
(3)B中溶液发生反应的离子方程式是_______。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是___________。
(5)过程Ⅲ实验的目的是__________。
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下_________,得电子能离逐渐减弱。
【答案】![]() 淀粉KI试纸变蓝 Cl2+2Br-═Br2+2Cl- 打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡。静止后CCl4层溶液变为紫红色 确认C的黄色溶液中五Cl2,排除Cl2对溴置换碘实验的干扰 原子半径逐渐增大
淀粉KI试纸变蓝 Cl2+2Br-═Br2+2Cl- 打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡。静止后CCl4层溶液变为紫红色 确认C的黄色溶液中五Cl2,排除Cl2对溴置换碘实验的干扰 原子半径逐渐增大
【解析】
验证卤素单质氧化性的相对强弱,装置A:高锰酸钾溶液和浓盐酸反应生成氯化锰、氯化钾、氯气和水,装置A中生成氯气,烧瓶上端湿润的碘化钾淀粉试纸变蓝色,验证氯气的氧化性强于碘,装置B:装置B中盛有溴化钠,氯气进入装置B中,氯气氧化溴离子为溴单质,溶液呈橙红色,验证氯的氧化性强于溴,氯气有毒,能被氢氧化钠吸收,浸有氢氧化钠的棉花防止氯气污染空气,当B和C中的溶液都变为黄色时,夹紧弹簧夹,为验证溴的氧化性强于碘,实验时应避免氯气的干扰,当B中溶液由黄色变为棕红色时,说明有大量的溴生成,此时应关闭活塞a,否则氯气过量,影响实验结论,以此解答该题。
(1)根据以上分析,黄绿色气体为氯气,由高锰酸钾和浓盐酸发生氧化还原反应生成,氯气中存在1对氯氯共用电子对,氯原子最外层达到8电子稳定结构,电子式为:![]() ,
,
故答案为:![]() ;
;
(2)淀粉变蓝色,说明有单质碘生成,说明氯气氧化性强于单质碘,
故答案为:淀粉KI试纸变蓝;
(3)氯气的氧化性强于溴,将氯气通入NaBr溶液中会有单质溴生成,发生反应的离子方程式为:Cl2+2Br-═Br2+2Cl-,
故答案为:Cl2+2Br-═Br2+2Cl-;
(4)为验证溴的氧化性强于碘,应将C中生成的溴加入到盛有KI溶液的D中,如发生氧化还原反应,则静至后CCl4层溶液变为紫红色,
故答案为:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D震荡.静至后CCl4层溶液变为紫红色;
(5)为验证溴的氧化性强于碘,实验时应避免氯气的干扰,当B中溶液由黄色变为棕红色时,说明有大量的溴生成,此时应关闭活塞a,否则氯气过量,影响实验结论,
故答案为:确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰;
(6)因同一主族元素,从上到下,电子层数依次增多,原子半径逐渐增大,元素的金属性逐渐增强,得电子能力逐渐减弱,
故答案为:原子半径逐渐增大。


科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式不正确的是
A.用石墨电极电解饱和食盐水:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B.明矾可以做净水剂:Al3++3H2O=Al(OH)3↓+3H+
C.向铁制器具上电镀铜,阴极的电极反应为:Cu2++2e-=Cu
D.向氢氧化镁浊液中滴入酚酞溶液,溶液变红:Mg(OH)2(s)Mg2+(aq)+2OH-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下表模型并结合有关信息,判断下列说法中不正确的是( )
B12结构单元 | SF6分子 | S8分子 | HCN | |
结构模型示意图 |
|
|
|
|
备注 | 熔点1873 K | — | 易溶于CS2 | — |
A.单质硼属于原子晶体,每个B12结构单元中含有30个B—B键和20个正三角形
B.SF6是由极性键构成的非极性分子
C.固态硫S8属于原子晶体
D.HCN的结构式为H—C≡N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图是1mol NO2(g)和1mol CO(g)反应生成CO2和NO过程中的能量变化示意图,已知E1=+134kJ·mol-1、E2=+368kJ·mol-1,若在反应体系中加入催化剂,反应速率增大,E1的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是________。请写出NO2和CO反应的热化学方程式:________。

(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
a:2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.5kJ·mol-1
b:NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+116.5kJ·mol-1
c:H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:CH4(g)+2H2S(g)![]() CS2(g)+4H2(g)。向恒容密闭容器中充入0.lmolCH4 和0.2molH2S,下图所示:
CS2(g)+4H2(g)。向恒容密闭容器中充入0.lmolCH4 和0.2molH2S,下图所示:

下列说法正确的是
A. 该反应的△H<O
B. X 点CH4的转化率为20%
C. X点与Y点容器内压强比为55:51
D. 维持Z点温度,向容器中再充入CH4、H2S、CS2、H2 各0.1mol 时V(正)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时纯水中存在电离平衡:H2OH++ OH-。下列叙述正确的是
A.升高温度,水的电离程度增大,c(H+)增大,pH<7,溶液显酸性
B.向水中加入少量氨水,平衡逆向移动,抑制水的电离,c(OH-)降低
C.向水中加入少量硫酸,c(H+)增大,由水电离出的 c(H+)>1×10-7 mol/L
D.向水中加入少量 NH4Cl 固体,![]() 结合水电离出的 OH-,由水电离出的c(H+)>1×10-7 mol/L
结合水电离出的 OH-,由水电离出的c(H+)>1×10-7 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2002年诺贝尔化学奖获得者的贡献之一是发明了对有机物分子进行结构分析的质谱法。其方法是让极少量的(10-9g)化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+……,然后测定其质荷比。某有机物样品的质荷比如下图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是( )


A. 甲醇 B. 丙烷 C. 甲烷 D. 乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将锌片和铜片按不同方式插入稀硫酸中,下列说法正确的是( )
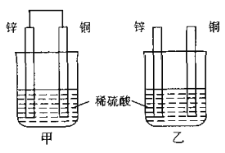
A. 甲中电子经导线从铜片流向锌片
B. 两烧杯中锌片上均发生还原反应
C. 两烧杯中铜片表面均无气泡产生
D. 一段时间后,两烧杯中溶液的c(H+)均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的实验,能达到实验目的的是
A | B | C | D |
|
|
片刻后在 Fe 电极附近滴入铁氰化钾溶液 |
|
验证化学能转化为电能 | 证明温度对平衡移动的影响 | 验证 Fe 电极被保护 | 验证AgCl 溶解度大于Ag2S |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com