
����Ŀ����1����ͼ��1mol NO2(g)��1mol CO(g)��Ӧ����CO2��NO�����е������仯ʾ��ͼ����֪E1��+134kJ��mol��1��E2��+368kJ��mol��1�����ڷ�Ӧ��ϵ�м����������Ӧ��������E1�ı仯��________(��������������С����������������ͬ)����H�ı仯��________����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ��________��

��2����CO2��NH3Ϊԭ�Ͽɺϳɻ�������[��ѧʽΪCO(NH2)2]����֪��
a��2NH3(g)+CO2(g)=NH2CO2NH4(s) ��H����159.5kJ��mol��1
b��NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ��H��+116.5kJ��mol��1
c��H2O(l)=H2O(g) ��H��+44.0kJ��mol��1
д��CO2��NH3�ϳ����غ�Һ̬ˮ���Ȼ�ѧ��Ӧ����ʽ��________��
���𰸡���С ���� NO2(g)+CO(g)=NO(g)+CO2(g) ��H=-234kJ��mol��1 2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l) ��H��-87kJ��mol��1
��������
��1����ͼ��֪�÷�ӦΪ���ȷ�Ӧ����Ӧ������������������������������H= E1-E2���ڷ�Ӧ��ϵ�м�����������Խ��ͷ�Ӧ�Ļ�ܣ������ı䷴Ӧ�ȣ�
��2�����ݸ�˹���ɽ��м��㲢��д�Ȼ�ѧ����ʽ��
��1����Ӧ��ϵ�м�����������Խ��ͷ�Ӧ�Ļ�ܣ������ı䷴Ӧ�ȣ����E1��С����H���䣻��H= E1-E2=134kJ��mol��1-368kJ��mol��1=-234 kJ��mol��1���Ȼ�ѧ����ʽΪ��NO2(g)+CO(g)=NO(g)+CO2(g) ��H=-234kJ��mol��1��
��2����Ӧa+b-c�ɵ�CO2��NH3�ϳ����غ�Һ̬ˮ���Ȼ�ѧ����ʽ��2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l) ��H��-87kJ��mol��1



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴ӦaA(g)��bB(g) ![]() cC(g)��dD(g)����H��ͬʱ����������ͼ�и����߹��ɵ��ǣ� ��
cC(g)��dD(g)����H��ͬʱ����������ͼ�и����߹��ɵ��ǣ� ��
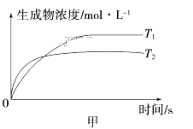
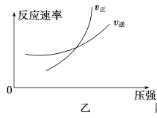
A.a��b>c��d��T1>T2����H>0
B.a��b>c��d��T1<T2����H<0
C.a��b<c��d��T1>T2����H>0
D.a��b<c��d��T1<T2����H<0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ȼ�����У�һ����ʹ�õľ۱���ϩ���ϴ����ġ���ɫ��Ⱦ����Ϊͻ�������ֲ������Էֽ⣬�����鷳��������Ƴ�һ�����͵IJ����ܴ���۱���ϩ���������������۶����ɵģ����ֲ��Ͽ�������������½��⡣���й��ھ�����(�ṹ��ʽΪ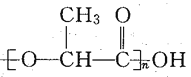 )��˵����ȷ����
)��˵����ȷ����
A.��������һ�ִ�����
B.��ۺϷ�ʽ�뱽��ϩ����
C.�䵥��Ϊ CH3��CH2��COOH
D.��������һ�����߷��Ӳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����![]() ʱ����Ũ��Ϊ
ʱ����Ũ��Ϊ![]() ��
��![]() ��
��![]() ��
��![]() ����Һ�У���֪����ĵ��볣��Լ����һˮ�ϰ��ĵ��볣���������ж���ȷ����
����Һ�У���֪����ĵ��볣��Լ����һˮ�ϰ��ĵ��볣���������ж���ȷ����![]()
A.��ˮ�������![]() ������
������![]()
B.������Һ��pHֵ��С��![]()
C.������Һ��![]() ������
������![]()
D.������Һ��ֻ��![]() �Լ���
�Լ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ߴ���������Ϊ�ϳ���������Ԫ�������ϵ�ԭ�ϣ���ҵ�Ͽ�����Ȼ�������̷������̿�(����Fe��Ni��Si��P��Ԫ��)�Ʊ����ش��������⣺
(1)��Ԫ����Ԫ�����ڱ��е�λ��____��![]() ����Ԫ��λ��ͬһ���壬��۲�����Ų�ʽ��___��
����Ԫ��λ��ͬһ���壬��۲�����Ų�ʽ��___��
(2)MnSO4�������ӵĿռ乹����____����ԭ�ӵ��ӻ�����______��
(3)�Ƚ�H2S ______H2Se���ȶ��ԣ�(��������������)�ж�������______���ȽϷе㣺N2H4 _____P2H4 (��������������)���ж�������______��
(4) FeCl3�еĻ�ѧ���������ԵĹ����ԣ�����״̬����˫�۷���(FeCl3)2����,������ṹ�������λ��__________��
(5)MnO����NaCl�ͽṹ(��ͼ)�����������Ӳ��������������ܶѻ���ʽ�����侧������Ϊapm����r(Mn2+)Ϊ______pm�����ܶ���_____g/cm3(�ú�a�ı���ʽ��ʾ)
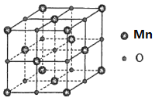
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���������İ�������粒��������ܱ������У�������Ӧ��NH2COONH4��s��![]() 2NH3��g��+CO2��g�����÷�Ӧ��ƽ�ⳣ���ĸ���������lgK��ֵ���¶ȣ�T���ı仯������ͼ��ʾ������˵������ȷ����
2NH3��g��+CO2��g�����÷�Ӧ��ƽ�ⳣ���ĸ���������lgK��ֵ���¶ȣ�T���ı仯������ͼ��ʾ������˵������ȷ����

A. �÷�Ӧ�ġ�H��0
B. A���Ӧ״̬��ƽ�ⳣ��K��A��=10��2.294
C. NH3�������������ʱ���÷�Ӧһ���ﵽƽ��״̬
D. 30��ʱ��B���Ӧ״̬����������< �����棩
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��֤±�ص��������Ե����ǿ����ijС������ͼ��ʾװ�ý���ʵ�飨�г���������ȥ���������Ѽ��飩��
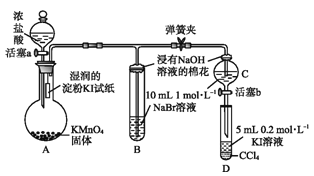
ʵ����̣�
��.���ɼУ�����a���μ�Ũ���ᡣ
��.��B��C�е���Һ����Ϊ��ɫʱ���н����ɼС�
��.��B����Һ�ɻ�ɫ��Ϊ��ɫʱ���رջ���a��
��������
��1��A�в�������ɫ���壬�����ʽ��________��
��2����֤������������ǿ�ڵ��ʵ��������_______��
��3��B����Һ������Ӧ�����ӷ���ʽ��_______��
��4��Ϊ��֤���������ǿ�ڵ⣬�������IJ�����������___________��
��5��������ʵ���Ŀ����__________��
��6���ȡ��塢�ⵥ�ʵ�������������ԭ��ͬ����Ԫ�ش��ϵ���_________���õ�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ʱ����
ʱ����![]() �����ܱ������г���
�����ܱ������г���![]() �ұ���������Ӧ��
�ұ���������Ӧ��
![]()
![]() ��
��
��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ�IJ������ݼ��±���
ʱ�� | 0 | 10 | 20 | 30 | 40 |
|
|
|
|
|
|
|
|
|
|
|
|
����˵����ȷ����![]()
![]()
A.ǰ![]() ��
��![]()
B.�����������������䣬�����¶ȣ�ƽ��ʱ![]() �ұ�
�ұ�![]() ����
����![]()
C.���������������䣬�������г��벻���뷴Ӧ��ˮ������Ϊϡ�ͼ������ұ���ת����Ϊ![]()
D.��ͬ�¶��£���ʼʱ�������г���![]() �ұ���
�ұ���![]() ����ϩ��
����ϩ��![]() ���ﵽƽ��ǰ
���ﵽƽ��ǰ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڲ�ͬ�����£�![]() ���ܱ������з������·�Ӧ
���ܱ������з������·�Ӧ![]() ����֪Y��Z����ʼŨ��Ϊ0��X��Ũ��
����֪Y��Z����ʼŨ��Ϊ0��X��Ũ��![]() �淴Ӧʱ��
�淴Ӧʱ��![]() �仯��������±���
�仯��������±���

����˵������ȷ����![]()
![]()
A.![]()
B.��ʵ��1�Ƚϣ�ʵ��2��Ӧ���ʼӿ죬ԭ������Ǽ����˺��ʵĴ�����������ϵѹǿ
C.��ʵ��3�У�![]() ʱ����ڷ�Ӧ��ϵ�ܹ����ٵ�X�����ʵ���Ϊ
ʱ����ڷ�Ӧ��ϵ�ܹ����ٵ�X�����ʵ���Ϊ![]()
D.��![]() �����˵��
�����˵��![]() ��
��![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com